同时攻击两个靶点?揭秘下一代抗癌利器“双特异性抗体”
双特异性抗体(双抗)作为免疫治疗领域的新兴方向,正推动肿瘤治疗迈向新的革命阶段。该类药物借助其独特的双靶点结合能力,在肿瘤微环境中精准引导免疫细胞,实现对癌细胞的高效清除。
自20世纪60年代概念提出至今,双抗技术已历经60年的发展。随着基因工程与抗体工程等分子生物学技术持续突破,双抗的研发与生产日趋成熟,逐渐成为癌症治疗领域的重要支柱。据药渡数据库统计,目前全球共有218款双抗药物处于临床及临床前研究阶段,其中157个已进入临床阶段,且多数处于临床I期[1]。随着研发不断深入,未来3–5年有望迎来双抗药物的上市高峰。
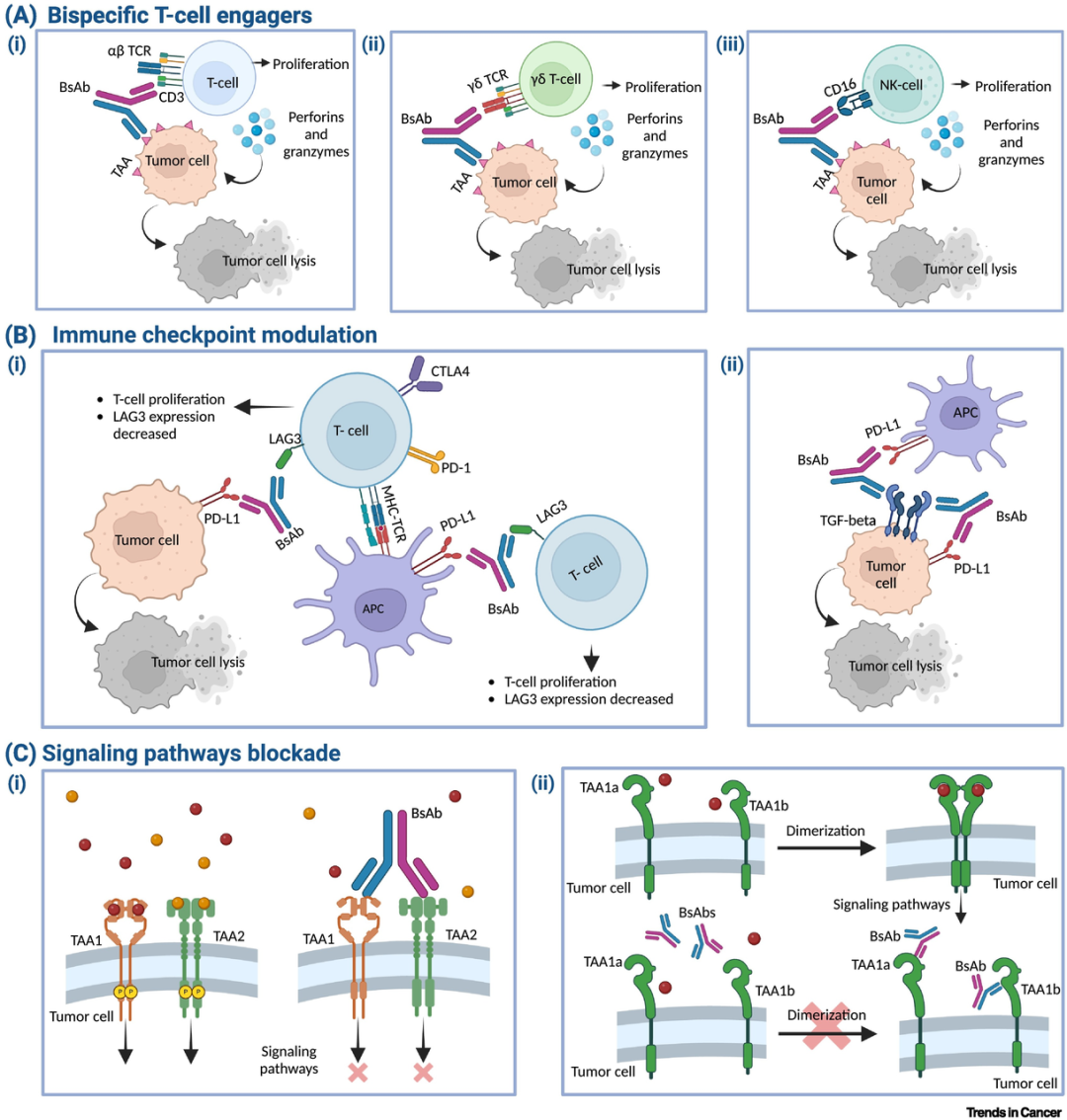
图1. 双抗药物类别[6]
双抗药物的作用机制
双特异性抗体是一种可同时特异性结合两个不同抗原表位的人工设计抗体。与天然抗体仅能靶向单一抗原不同,双抗通过化学偶联、重组DNA或细胞融合技术,将两个不同的重链与轻链组合,从而获得双重特异性。这一结构使其能够同时结合肿瘤细胞表面的肿瘤相关抗原和免疫效应细胞(如T细胞)表面的CD3共受体,在二者之间构建“免疫突触”。
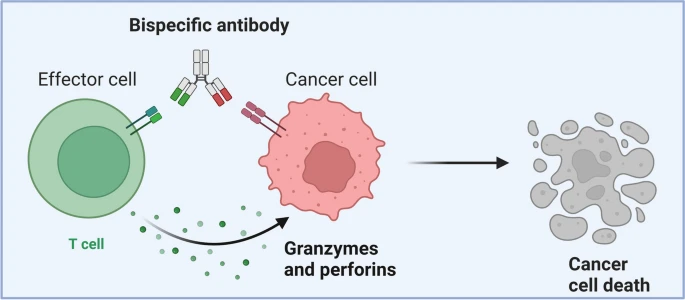
图2. 双抗作用机制[5]
该免疫突触可介导肿瘤细胞发生凋亡。此外,双抗还能促进T细胞活化、增殖以及幼稚T细胞向记忆表型分化,进而调节T细胞功能。
根据结构差异,双抗可分为两类:含Fc片段的IgG样双抗(全长型双抗)和不含Fc片段的非IgG样双抗(片段型双抗)。这一结构区别直接影响其生物活性、半衰期及生产工艺。
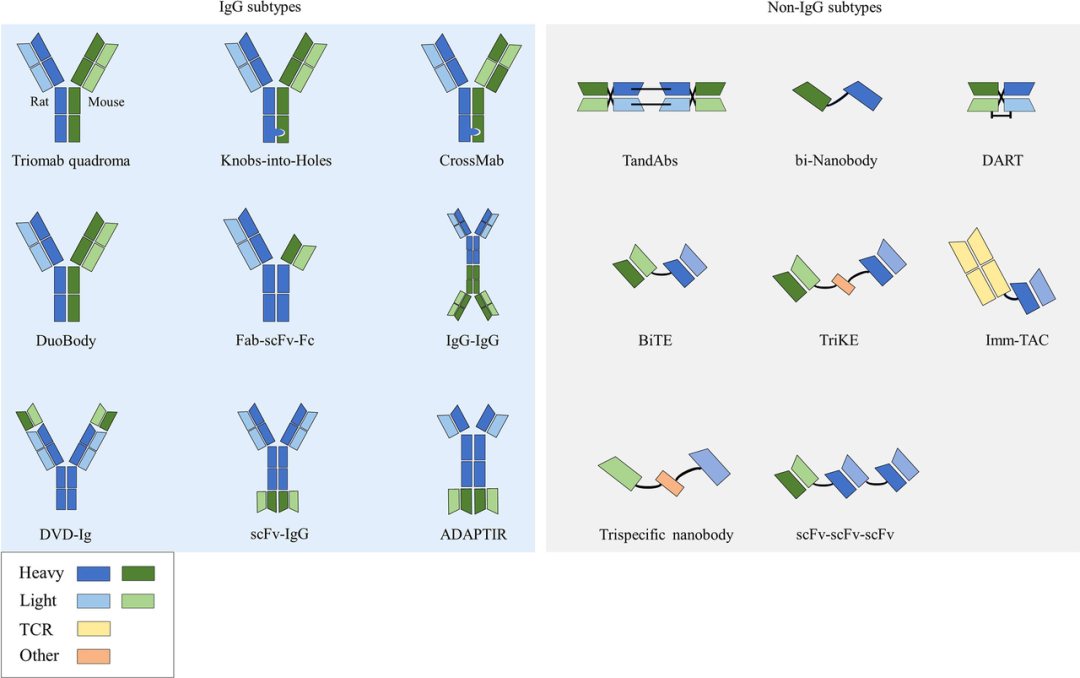
图3. 双特异性抗体类型[4]
IgG样双抗具备Fc介导的效应功能,如抗体依赖性细胞介导的细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)及抗体依赖细胞介导的细胞吞噬作用(ADCP),可进一步增强抗肿瘤效果。而非IgG样双抗仅依赖抗原结合发挥作用,免疫原性较低,安全性较好,且因分子量较小而更具肿瘤组织渗透能力。
双抗药物研发前沿与临床进展
目前,双抗药物已在多个疾病领域(尤其是肿瘤治疗)表现出显著疗效。全球范围内已有多个双抗药物获批上市,其中部分品种年销售额超过20亿美元[1]。
在血液肿瘤方面,双抗药物取得多项突破。针对多发性骨髓瘤,靶向BCMA、GPRC5D、FcRH5等抗原的双抗显示出卓越疗效。例如,基于MajesTEC-1研究结果,特立妥单抗成为首款获批用于复发难治多发性骨髓瘤(RRMM)的双抗药物。长期随访数据显示,43%的患者达到完全缓解或严格意义的完全缓解,中位无进展生存期和总生存期分别为12.5个月和21.9个月[2]。
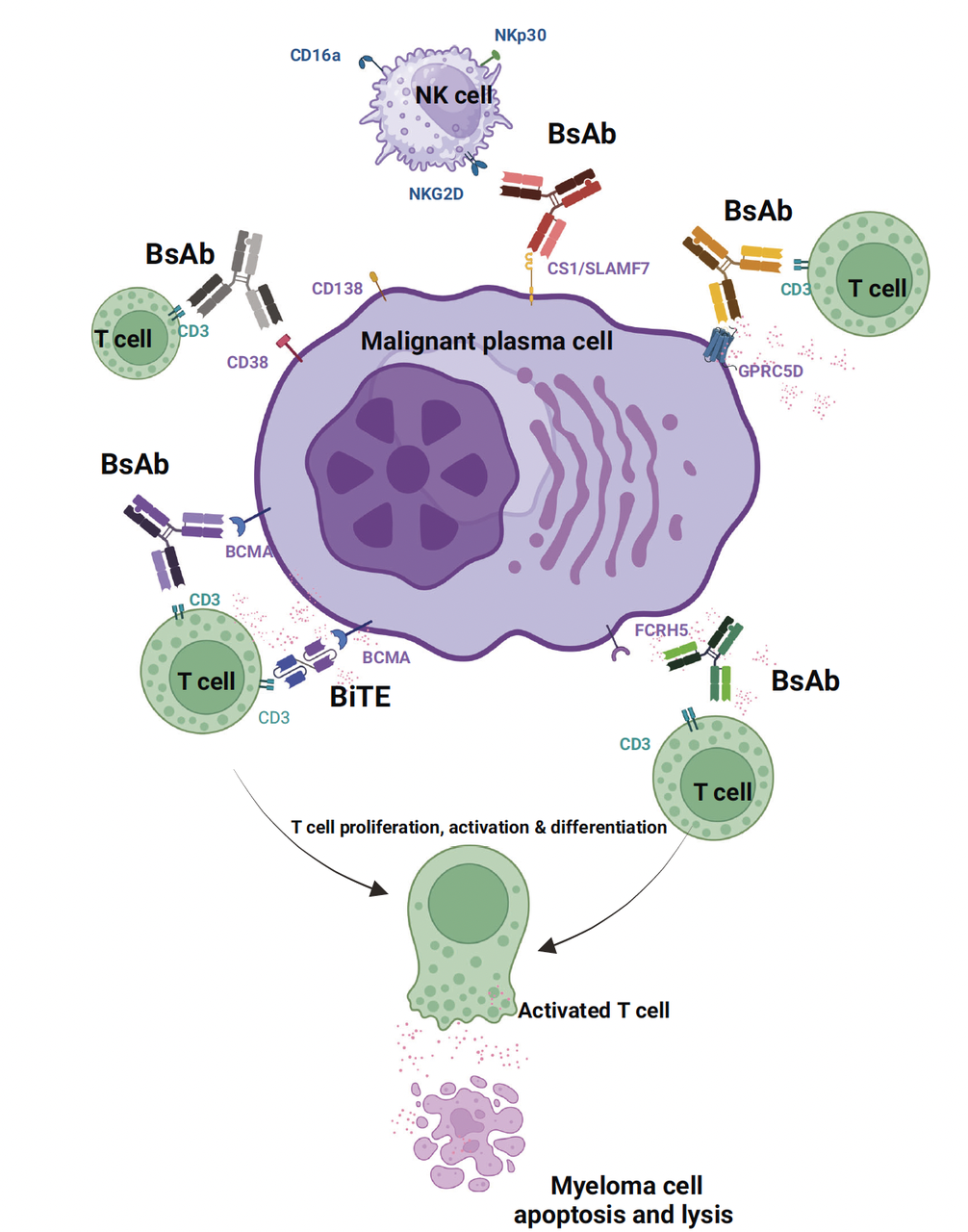
图4. 双特异性抗体针对骨髓瘤细胞的特异性抗原靶点[2]
在实体瘤领域,双抗同样展现出广阔前景。例如,在非小细胞肺癌(NSCLC)中,多项双抗药物的临床试验取得积极成果。PD-L1/TGF-β双抗SHR-1701的一项药效研究表明,对于不可手术的III期NSCLC患者,联合化疗方案的客观缓解率(ORR)达58%,且安全性良好[3]。
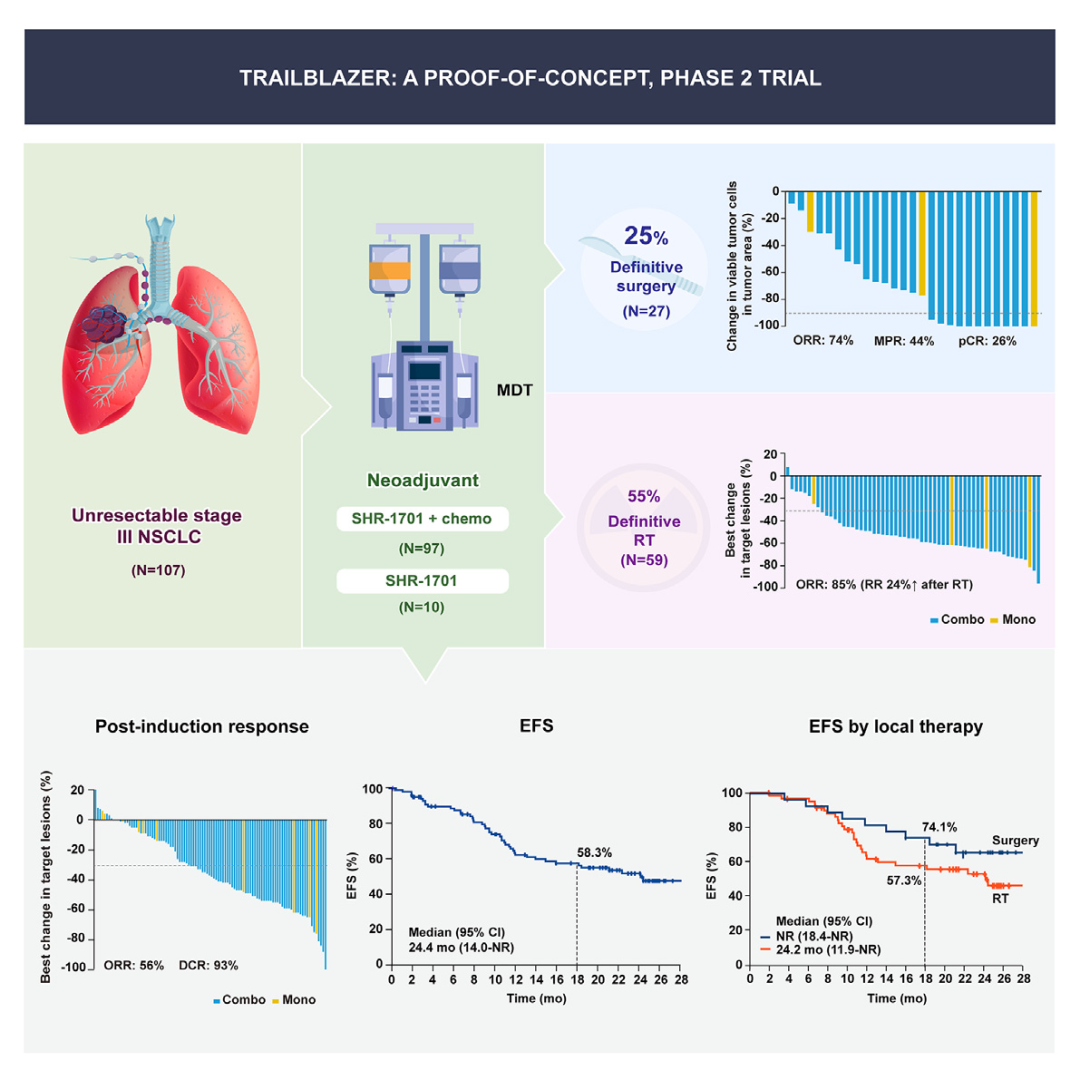
图5. SHR-1701 II期临床试验数据[3]
双抗药物的靶点选择也日趋多样,目前热点包括免疫检查点分子(如PD-1、PD-L1、CTLA-4、TIGIT)、肿瘤特异性抗原(如EGFR、HER2、DLL3)以及肿瘤微环境中的免疫抑制分子(如VEGF-A、TGF-β)。靶点的多样性助力双抗药物开发出更具个体化特色的治疗方案。
双抗药物面临的挑战与未来方向
尽管双抗药物潜力巨大,其研发与应用仍面临多项挑战:
生产工艺复杂:主要瓶颈之一是“链错配问题”。当两种重链与两种轻链组合时,可能产生16种不同组合,其中仅12.5%具备目标双特异性;
药物属性需优化:包括免疫原性、稳定性和肿瘤靶向特异性等。尤其是非IgG样双抗血清半衰期较短,例如已上市药物Blincyto半衰期仅约2小时,远低于常规单抗药物(通常超过100小时),可能导致患者需频繁给药,影响治疗依从性。
为应对上述挑战,各类研发平台正通过以下策略优化双抗设计:
结构优化:引入Fc区以显著延长半衰期;
增加分子量:构建多聚体结构,改变清除途径(经肝脏而非肾脏),从而延长药物滞留时间。
未来双抗药物的重点发展方向包括:探索新靶点组合(特别是传统“不可成药”靶点)、优化结构以平衡疗效与毒性、开发个体化治疗策略以及探索联合治疗方案。
双抗药物研发支持:集萃药康模型资源
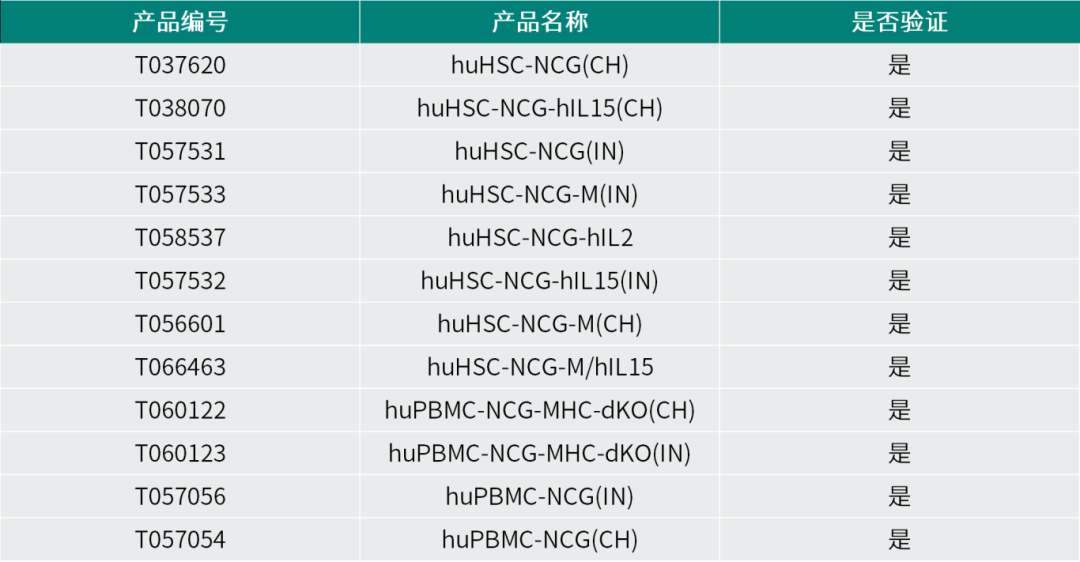
在双抗药物从概念向临床转化的过程中,小鼠模型发挥关键作用。靶点人源化小鼠通过替换关键免疫靶点为人源序列,缓解种属差异带来的药效评估偏差;人源化细胞系可用于验证双抗的桥接活性、细胞毒性及协同效应,加速候选分子筛选与亲和力优化;免疫重建模型则通过人源化免疫细胞,模拟双抗在人体免疫微环境中的作用机制。三者共同构成从机制研究到药效验证的完整闭环,显著提高研发成功率。
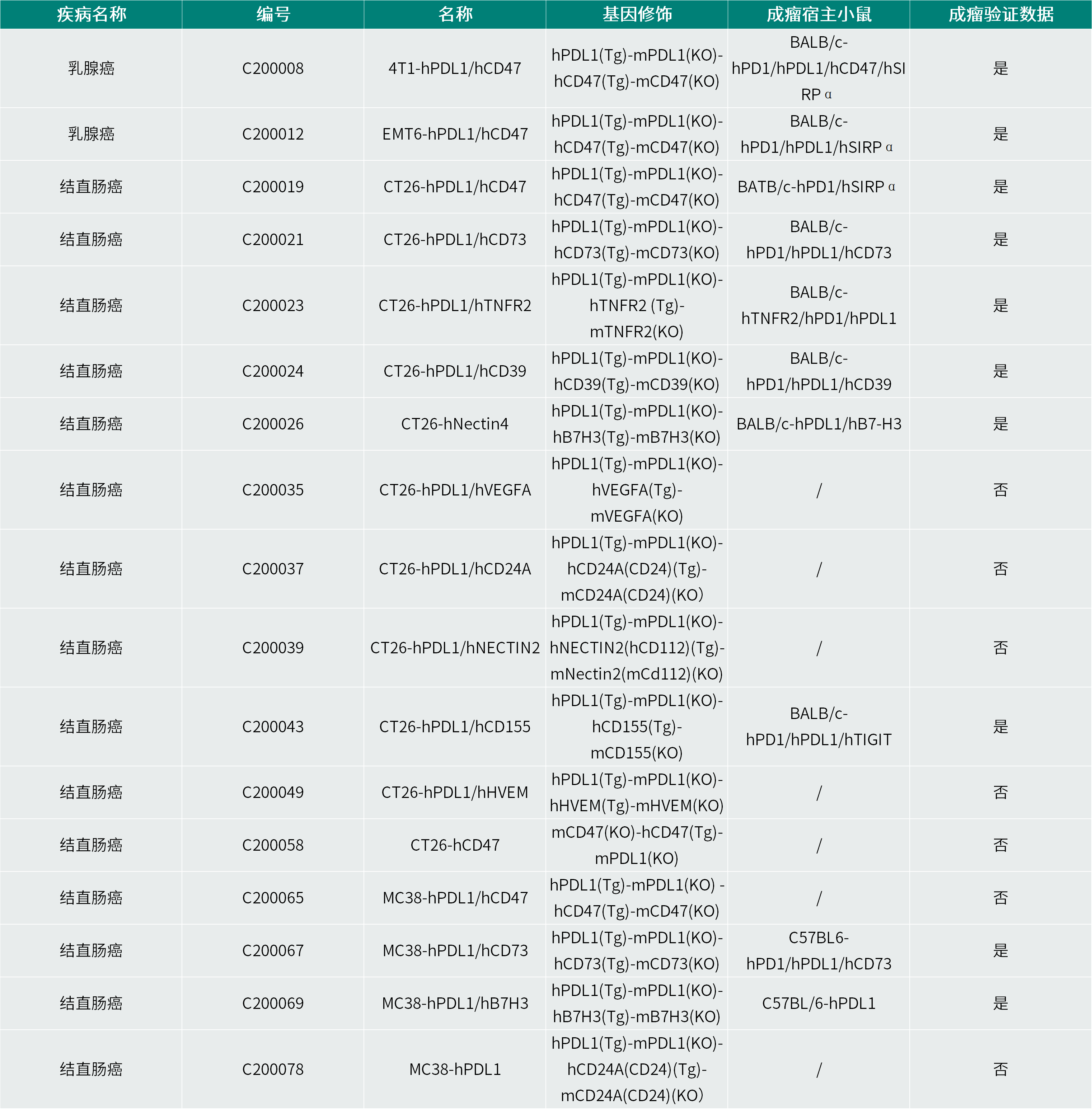
针对双抗药物研究的需求,集萃药康开发了多种适用于双抗验证的小鼠模型,并建立了相关靶点的人源化细胞系资源库。这些模型与细胞资源可有效模拟人类肿瘤微环境及免疫系统特征,为双抗药物的机制研究、药效评价与安全性评估提供可靠平台。除动物模型外,集萃药康还提供一站式药理药效评价服务,覆盖从早期靶点验证、候选药物筛选至临床前药效与Non-GLP安全性评价的全研发流程。
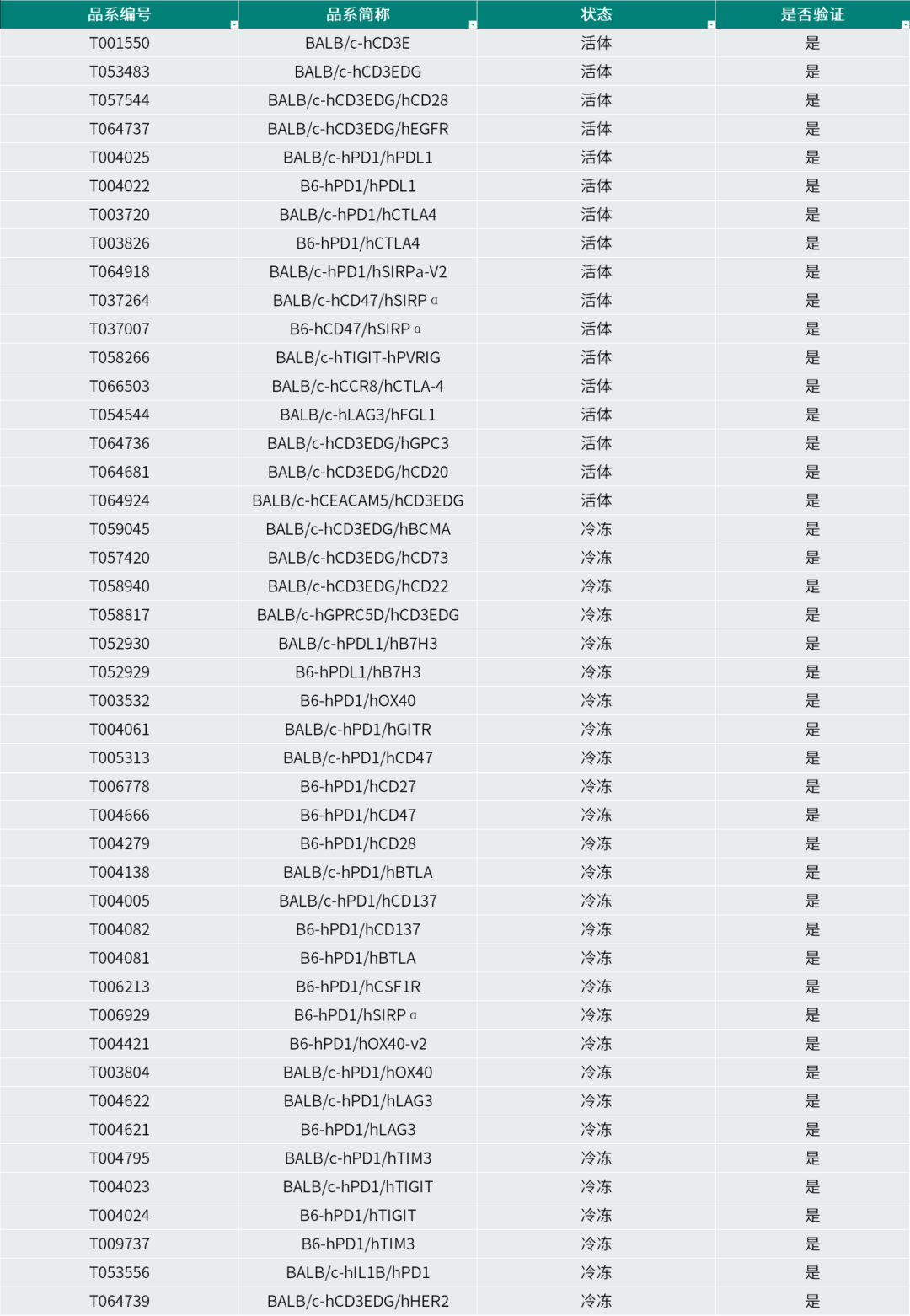
集萃药康部分双抗药物相关人源化细胞系
集萃药康部分免疫重建小鼠资源
随着双抗药物研发进入快速发展阶段,小鼠模型作为连接基础研究与临床应用的桥梁,其重要性日益凸显。集萃药康将持续为全球科研团队提供高质量模型与技术服务,共同推动双抗药物进步,为患者带来新的治疗希望。
参考文献
[1] 双抗综述|已有 24 亿美元重磅品种,3-5年迎来上市爆发期. 健康界. 2025-09-19.
[2] Blood Cancer J . 2024 Sep 12;14(1):158.
[3] Cancer Cell.2024 Jul 8;42(7):1258-1267.e2.
[4] Front Immunol.2022 Oct 20:13:1020003.
[5] Cell Commun Signal . 2024 Mar 12;22(1):179.[6] Trends Cancer . 2024 Oct;10(10):893-919.

