革新抗体药研发: hFcRn人源化小鼠模型,破解临床前PK预测难题
自1975年杂交瘤技术推动单克隆抗体药物诞生以来,抗体类药物(如单抗、ADC)已在临床得到广泛应用,其适应症覆盖了癌症、自身免疫性疾病、传染病乃至神经退行性疾病等多种领域。与传统小分子药物不同,抗体药物的药代动力学(PK)特性受多重复杂机制调控:靶点介导的药物处置(TMDD)可能导致非线性药代动力学;而IgG类抗体之所以能拥有长达数周的半衰期,其核心秘诀便在于一种关键的受体——新生儿Fc受体(FcRn)所介导的再循环机制。
FcRn工作机制详解:为何它是维持抗体药物长效循环的关键受体?
FcRn在母体IgG抗体的转运以及保护IgG免遭降解方面扮演着关键角色。尽管被称作“新生儿”,Fc受体FcRn的表达几乎遍布全身:不仅在肠道、胎盘、肾脏和肝脏等重要器官中存在,也广泛分布于上皮细胞、内皮细胞以及造血细胞中。[1]
从结构上看,FcRn是由一个β2-微球蛋白(β2M)轻链和一个MHC I类样重链组成的异源二聚体。[2] 它能与IgG的CH2和CH3结构域结合,这种相互作用具有高度pH依赖性,这对FcRn保护IgG免于被分解至关重要。
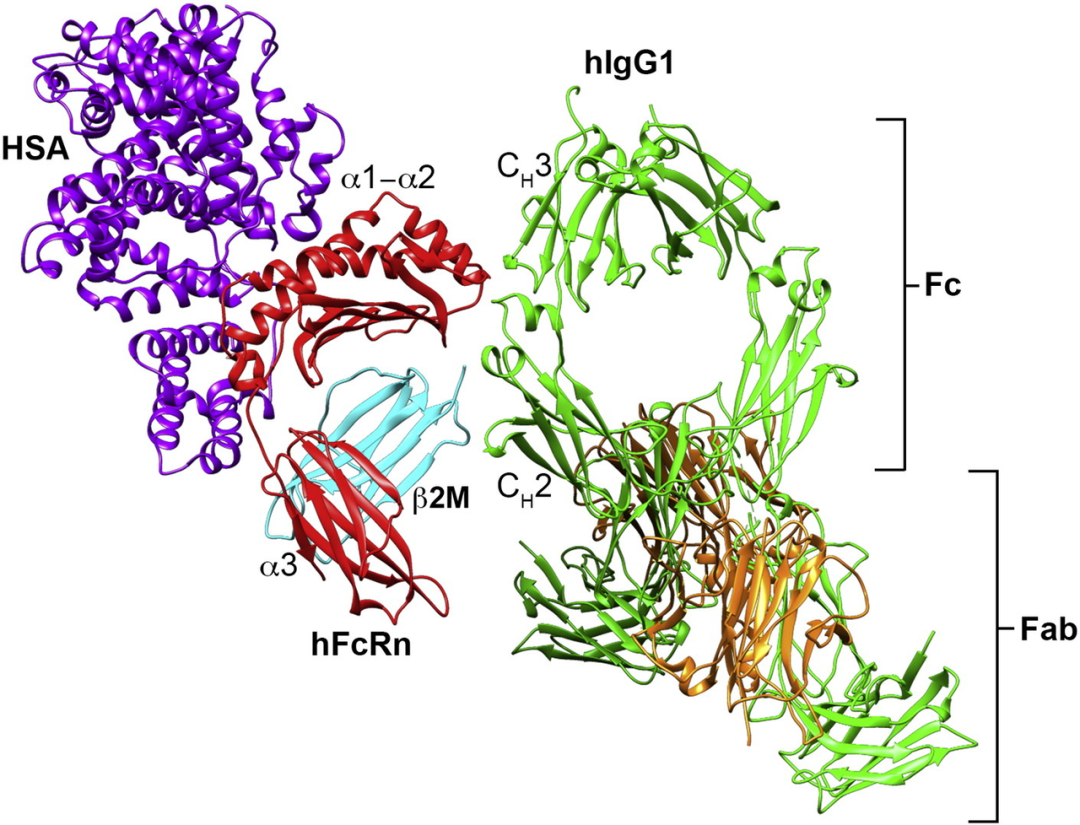
图1. hFcRn与hIgG1和人血清白蛋白结合的结构示意图[2]
在酸性内体环境中(pH约为6.0),FcRn会与IgG紧密结合,形成的复合物随后在细胞内循环,使IgG避免在溶酶体中被降解。当复合物到达血液等中性或微碱性pH环境时,IgG便与FcRn解离,被释放回循环系统中。[3] 这一机制使得大多数IgG亚类(如IgG1、IgG2和IgG4)拥有极长的血清半衰期,可达约21天。而IgG3因其FcRn结合位点存在单一氨基酸差异,半衰期缩短至约7天。
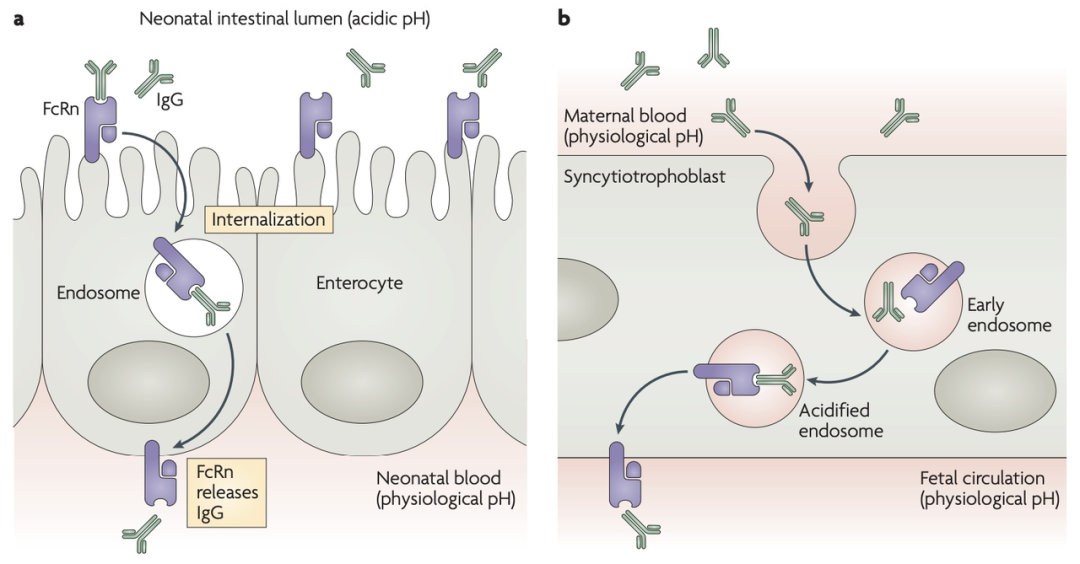
图2. FcRn介导的IgG循环保护作用[2]
FcRn介导的这种循环利用机制,对于免疫系统维持体内足够水平的循环抗体至关重要。这一机制使得FcRn成为抗体药物开发的战略靶点:通过改造抗体Fc段与FcRn的结合特性,科学家可精准调控药物半衰期,优化其药代动力学特性,为新一代长效疗法赋能。然而,FcRn介导的IgG循环利用具有物种特异性。
在药物研发过程中,小鼠是进行疾病模型构建和临床前药代动力学研究的常用体内模型,科学家利用它来评估抗体在生物体内的吸收、分布、代谢和排泄等过程。但人源IgG与小鼠FcRn的结合力通常强于其与人类自身FcRn的结合,这往往导致人源抗体在小鼠体内的半衰期被延长。[4] 这种种属差异会使传统野生型小鼠模型无法真实模拟人源抗体代谢过程,导致临床前数据与人体试验结果存在显著偏差。
解决方案:B6-hFcRn人源化小鼠模型的构建策略与核心优势
为突破这一瓶颈,集萃药康开发的B6-hFcRn(品系编号:T065498)人源化小鼠模型通过精准基因编辑技术,将FcRn的亚基FCGRT人源化,确保人源FcRn蛋白在生理环境中的自然表达与调控。该模型显著提升了临床前研究的转化价值:它能精准评估FcRn靶向及IgG类疗法的体内药效、机制与PK特性,为后续临床开发提供高置信度的决策依据,降低研发风险。
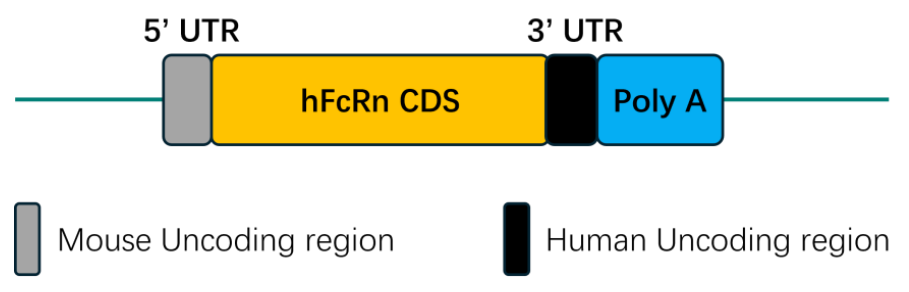
图3. B6-hFcRn小鼠模型品系策略
FcRn与抗体药代动力学:模型有效性的分子基础
蛋白水平验证:WB结果证实B6-hFcRn小鼠成功实现mFcRn敲除与hFcRn表达
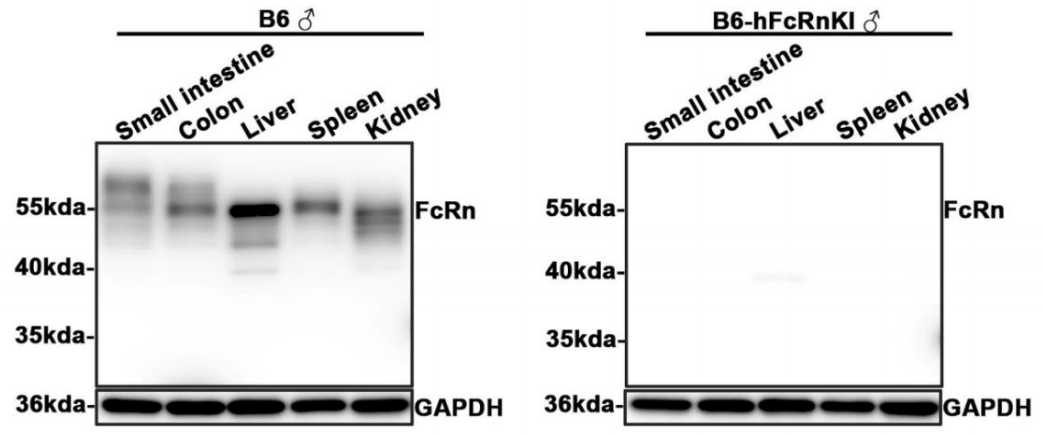
图4. mFcRn表达检测
使用仅识别mFcRn抗体通过蛋白质免疫印记(WB)检测mFcRn表达情况。可以发现B6小鼠小肠、结肠、肝脏、脾脏、肾脏均有mFcRn表达(阳性条带位置 55 kDa),其中肝脏mFcRn表达信号最强。B6-hFcRn小鼠各组织脏器均未检测到mFcRn表达。说明B6-hFcRn小鼠内源性mFcRn完全敲除。
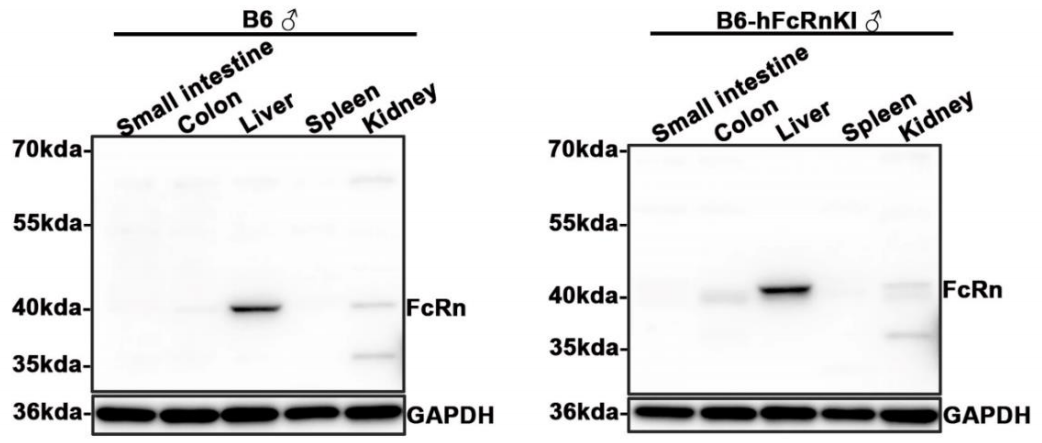
图5. mFcRn、hFcRn表达检测
使用可识别mFcRn和hFcRn的抗体通过WB检测mFcRn和hFcRn表达情况。可以发现B6小鼠肝脏、结肠、肾脏均有FcRn表达(阳性条带位置40kDa),其中肝脏FcRn表达信号最强。B6-hFcRn小鼠肝脏、结肠、肾脏均有FcRn表达(阳性条带位置40kDa),其中肝脏FcRn表达信号最强。结合图4数据可以判断B6-hFcRn小鼠不表达mFcRn,仅表达hFcRn。
案例验证一:为何使用B6-hFcRn预测抗体药物半衰期更加精准?
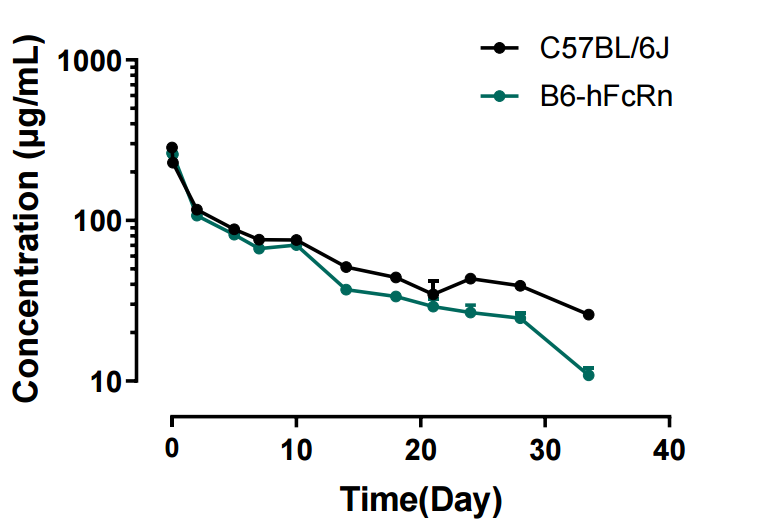
图6. Pembrolizumab在B6和B6-hFcRn小鼠中的血药浓度曲线
表1. Pembrolizumab在B6、B6-hFcRn小鼠和人中的半衰期

*参考Pembrolizumab在人体的群体药代动力学参数;小鼠数据采用336h-672h时间点进行曲线拟合。
相比于B6,Pembrolizumab在B6-hFcRn小鼠中的药物半衰期更接近人的药物半衰期,临床预测价值更高。
FcRn与抗体工程改造:优化药物半衰期的关键策略
在针对pH依赖性FcRn结合所设计的多种Fc工程变体中,M252Y/S254T/T256E(YTE)是研究最为深入、并已在临床上证实可显著延长多种治疗性IgG抗体血浆半衰期的代表性变体。由于人源IgG的Fc片段与小鼠FcRn(mFcRn)和人FcRn(hFcRn)之间的识别序列存在显著差异,在野生型小鼠中难以区分经YTE改造的Fc与未改造Fc在体内的药代动力学行为。而B6-hFcRn小鼠模型通过将FcRn完全人源化,可在抗体早期优化阶段提供更贴近人体情况的药代动力学参考数据。
案例验证二:在B6-hFcRn模型中评估YTEFc改造对抗体PK参数的优化效果
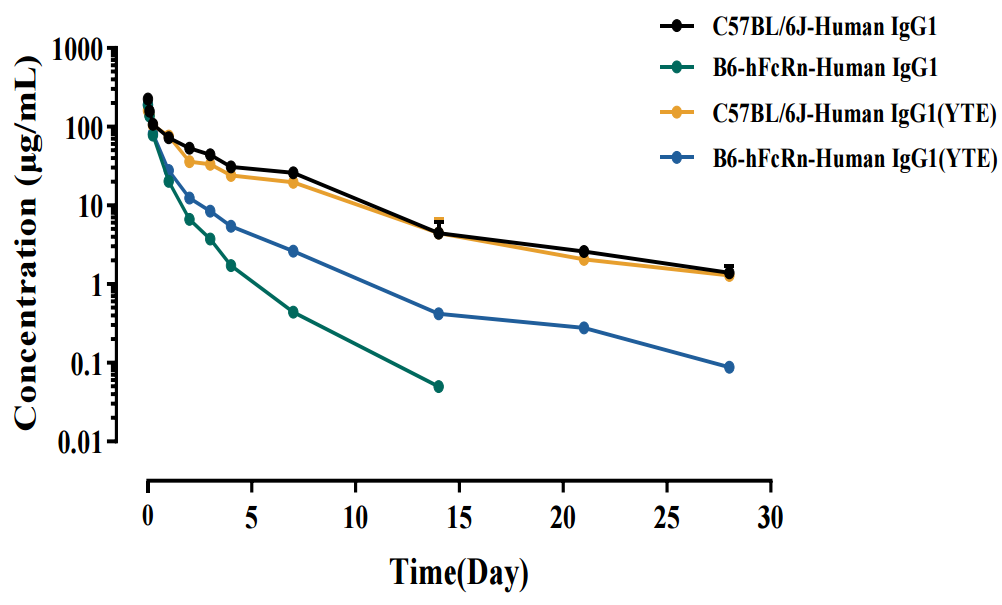
图7. Human IgG1 Fc段YTE改造前后在B6和B6-hFcRn小鼠中的血药浓度曲线
表2. 抗体YTE改造前后,在B6和B6-hFcRn小鼠中的药代参数

Human IgG1经过YTE改造后,在B6-hFcRn小鼠中的药物半衰期延长,清除率降低。而在B6中,Human IgG1经过YTE改造后,半衰期缩短,清除率上升。相比于B6,B6-hFcRn小鼠能够准确反映抗体Fc端改造后的药物半衰期变化。
鉴于野生型小鼠无法模拟人体FcRn机制,其药代动力学数据可能存在显著偏差,参考价值有限。上述案例表明,B6-hFcRn小鼠在评价抗体的药代动力学方面具有显著优势。该模型可提供关键且可靠的药代参数,更为早期研发中的改造策略提供明确指导,显著节省时间成本。

总结与展望:hFcRn人源化模型在抗体药物研发中的核心价值与未来方向
B6-hFcRn人源化小鼠模型已成为抗体药临床前PK研究的核心工具;此外,hFcRn/hHSA双靶点人源化模型的研发正加速推进中。集萃药康已构建超800种基因人源化动物模型,致力于为准确评估靶向药物的疗效和安全性提供更有力工具,助力全球药企跨越“临床前-临床”转化鸿沟。
参考文献
[1] Qi T, Cao Y. (2021). Int J Mol Sci, 22(6):3048.
[2] Sockolosky, J. T., & Szoka, F. C. (2015). Advanced Drug Delivery Reviews, 91, 23–32.
[3] Roopenian, D., Akilesh, S. (2007). Nat Rev Immunol, 7, 715–725.
[4] Ober, R. J., Radu, C. G., Ghetie, V., & Ward, E. S. (2001). International Immunology, 13(12), 1551–1559.

