肥胖比衰老更可怕?顶刊小鼠代谢研究解密真相
近日,一项发表于《Cell Metabolism》的研究通过系统分析小鼠衰老与肥胖的代谢差异,提出了一个颠覆性观点:肥胖对代谢健康的破坏力可能比衰老更严重。研究发现,尽管衰老伴随广泛的代谢物浓度变化,但核心代谢通量(即代谢物在全身的生产和消耗速率)却异常稳定;而肥胖则直接导致代谢通量失控,这种破坏性变化远超衰老的影响。这一发现重新定义了我们对代谢健康与年龄关系的理解。

研究背景
代谢紊乱一直被公认为衰老的典型特征。既往研究表明,衰老会导致哺乳动物每日能量消耗下降、脂肪堆积、胰岛素抵抗等现象,这些发现推动了各种抗衰老干预手段的研究。然而,现有研究存在明显空白:对衰老过程中代谢通量(代谢反应的实时速率)的变化了解有限,更缺乏衰老与肥胖对代谢影响的系统对比。
衰老的表面现象:代谢物浓度的大范围变化
研究人员首先比较了年轻(3-6个月)与老年(21个月以上)小鼠的血清代谢组学特征。结果发现,约30%的代谢物浓度随年龄增长发生显著改变,5%存在“年龄×性别”交互作用。老年小鼠表现出血糖降低、酮体减少、甘油三酯下降等现象,同时瘦素和胰岛素水平升高(图1B、C、D),且生命周期队列中年龄相关代谢物多呈近似线性变化趋势,明确了衰老对C57BL/6小鼠循环代谢物的广泛且特异性影响。这些变化描绘了一幅代谢功能退化的画面,与我们对衰老的传统认知一致。
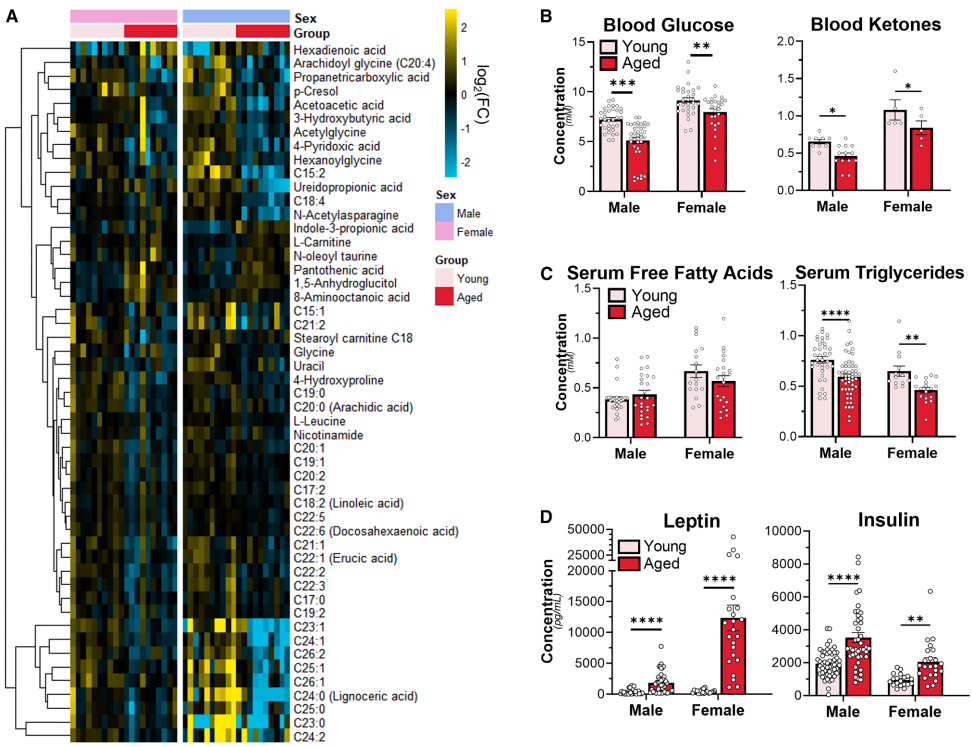
图1. 衰老重塑血清代谢组
然而,这些浓度变化只是表象。当研究人员深入探究代谢通量时,发现了截然不同的故事。
代谢通量分析:衰老与肥胖的惊人差异
通过稳定同位素示踪技术,研究团队测量了主要循环代谢物的通量。结果令人震惊:尽管多种代谢物浓度变化显著,但核心代谢通量在衰老过程中保持高度稳定。在定义为核心通量(>100 nmol/min/小鼠)的所有代谢物中,只有谷氨酰胺的通量显示出显著变化(约增加30%),其他核心代谢通量均未见明显改变(图2B、D)。这表明,衰老虽引发代谢物波动,但机体通过调节机制维持了代谢活动的稳态。
与衰老的保守模式相反,年轻的肥胖小鼠(ob/ob模型)表现出代谢通量的广泛紊乱。研究显示,肥胖小鼠的葡萄糖、乳酸和甘油通量较年轻WT小鼠显著增加50%-85%,同时亮氨酸、赖氨酸通量上升,而缬氨酸、蛋氨酸通量下降(图2C、D)。这种变化涉及多个核心代谢途径,说明肥胖对核心代谢途径活性的干扰远大于衰老。
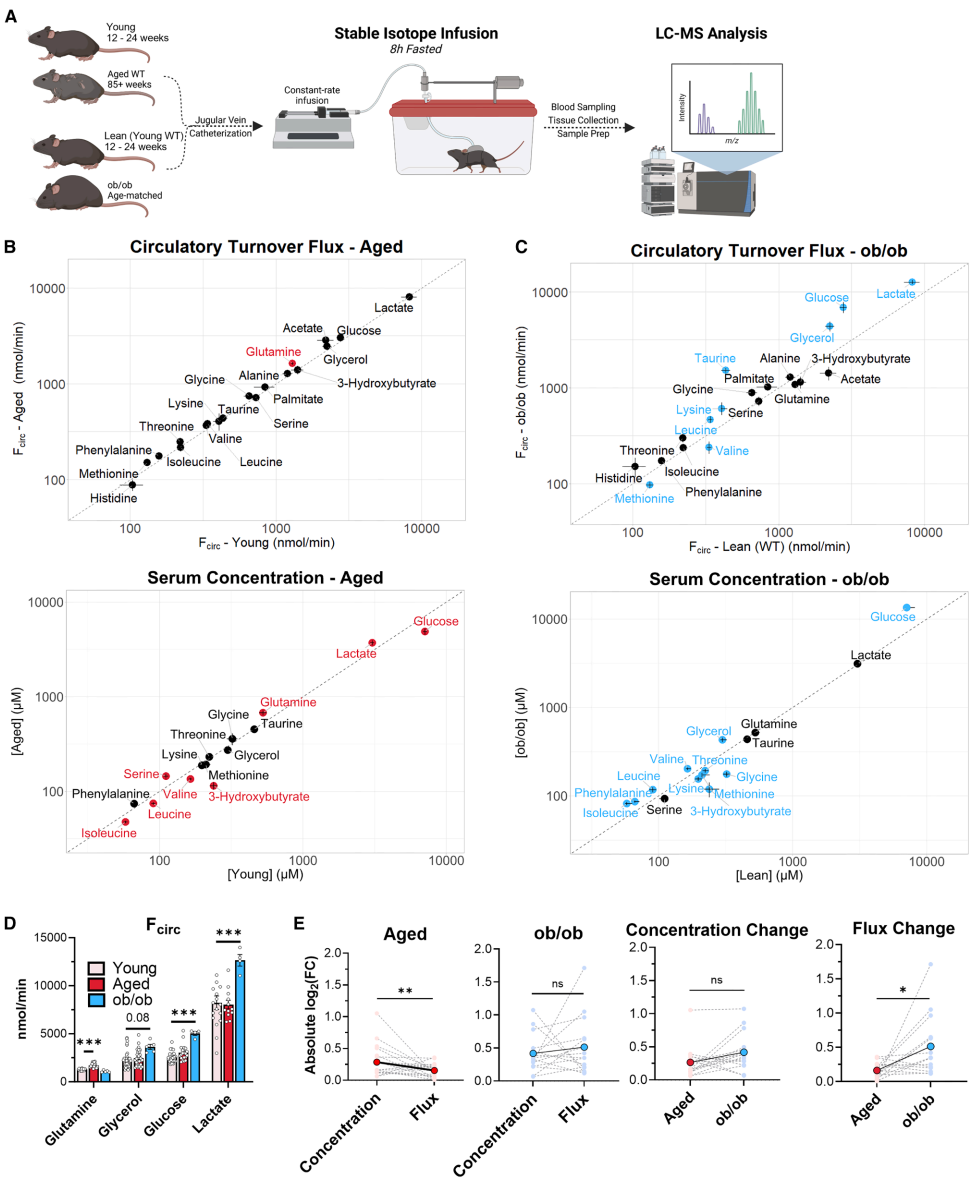
图2. 核心代谢通量在衰老时比在肥胖时维持得更好
进一步量化分析揭示,肥胖引起的通量变化幅度也显著大于衰老(图2E)。例如,肥胖导致糖异生和脂解加速,而衰老中这些通量被胰岛素升高所抑制。研究指出,肥胖通过脂肪堆积→脂解增强→甘油释放→糖异生加速的连锁反应,颠覆了能量代谢网络,而衰老则通过代偿机制缓冲了类似冲击。
深层机制:为什么肥胖更可怕
肥胖的代谢紊乱与疾病风险直接挂钩。研究中,肥胖小鼠呈现高血糖、高胰岛素抵抗特征,这与人类2型糖尿病和心血管疾病模型高度吻合。相反,老年小鼠虽有代谢物浓度变化,但通量稳定暗示其代谢弹性仍存。团队进一步通过同位素追踪发现,肥胖独特的通量变化(如牛磺酸通量翻倍)未出现于衰老组(图3),提示肥胖激活了衰老中不存在的病理途径。例如,肥胖中脂肪堆积会持续促进炎症和氧化应激,而衰老的代谢变化更多是适应性调整。
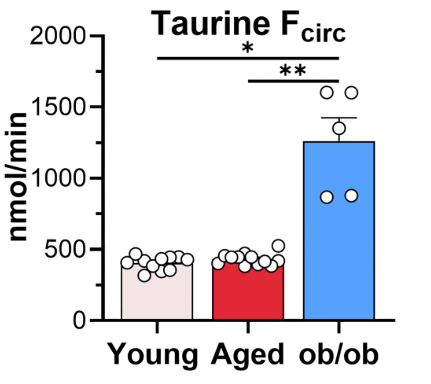
图3. 牛磺酸水平
此外,组织水平分析显示,衰老小鼠的代谢变化在脑和肠道等器官中较轻微,而肥胖则引起全身性紊乱。例如,肥胖中牛磺酸通量增加可能与能量代谢失衡有关,而衰老中仅谷氨酰胺通量上升,其下游效应有限(如轻微增加TCA循环活性)。这说明肥胖对代谢基础的腐蚀是全面性的,而衰老的影响相对局部。
启示与展望
这项研究以C57BL/6小鼠为模型,不仅刷新了对衰老代谢的理解,更警示肥胖的潜在危害。作者强调,衰老是渐进的、部分可代偿的代谢调整,而肥胖是急性的代谢失控。对于人类健康,控制肥胖或许比抗衰老干预更具紧迫性。这一发现为代谢性疾病的防治提供了新方向,也提醒我们重新审视衰老与代谢的关系。
本研究的重要发现得益于C57BL/6小鼠模型的遗传一致性和生理稳定性。集萃药康深耕实验动物模型领域,拥有包括C57BL/6JGpt老龄鼠(品系编号:T065274)和B6-ob小鼠(品系编号:T001461)在内的重要模型资源,为衰老、代谢等相关研究提供黄金标准。
老龄鼠模型优势

*本文使用的图片均来自原文献,点击文末“阅读原文”可查看

参考资料
[1]Jankowski, Connor S.R. et al., Cell Metabolism, Volume 37, Issue 11, 2280 - 2294.e4
[2]https://mp.weixin.qq.com/s/JfP1BVRwivZQ6MN_K2Z7vA

