肿瘤抗原哪家强?国际顶级期刊《Nature Cancer》重磅研究给出颠覆性答案
传统观点认为,肺癌和恶性黑色素瘤患者对免疫检查点阻断(ICB)治疗响应更好,源于其较高的肿瘤突变负荷(TMB)。高TMB意味着肿瘤细胞可能产生更多由基因突变引发的新抗原(突变肿瘤特异性抗原,mTSAs)。这些mTSA是肿瘤特异性的异常蛋白片段,容易被免疫系统识别为 “异物”,进而激发抗肿瘤免疫反应。
然而,临床实践对这一传统认知提出了挑战。不少ICB治疗有效的患者,治疗前TMB并不高;相反,部分高TMB患者的治疗效果却不理想。这表明TMB与ICB治疗效果之间的关系并非如传统理论描述得那么简单,实际关联更为复杂。
《Nature Cancer》发表的题为“Tumor antigens preferentially derive from unmutated genomic sequences in melanoma and non-small cell lung cancer” 的研究论文,通过先进的蛋白质基因组学分析,得出了惊人结论:在非小细胞肺癌(NSCLC)和黑色素瘤中,99% 的肿瘤抗原源自未突变基因序列。这一发现彻底打破了传统认知,为肿瘤免疫治疗的理论基础带来了全新视角。
研究人员对26例非小细胞肺癌和12例皮肤黑色素瘤活检样本,以及多个黑色素瘤细胞系的免疫肽组(即MHC I类相关肽[MAPs]的总和)进行了蛋白质基因组学分析。同时,他们还重新分析了7例患者来源的黑色素瘤细胞系的RNA测序和配对免疫肽组学数据。
研究方法主要包括:利用批量RNA测序构建样本特异性数据库;针对该数据库搜索每个样本中MAPs的串联质谱(MS/MS),识别特征性肽降解模式;确定了独特MAP序列;最后评估这些序列的RNA编码情况、基因组定位以及在健康组织和癌组织中的表达情况,从而对肿瘤抗原(TA)候选物进行分类。
这些MAP类别多样,包括:来自健康组织中未表达的经典或非经典突变肿瘤特异性抗原(mTSA);基于健康组织中不存在或极低表达的异常表达肿瘤抗原(aeTSA);当抗原表达仅限于正常肺或皮肤时的谱系特异性抗原(LSA);以及在其他健康组织中有显著表达、且在癌症基因组图谱(TCGA)中至少过表达两倍的肿瘤相关抗原(TAA)。在鉴定出的肿瘤抗原中(非小细胞肺癌样本有 90 个,黑色素瘤样本和细胞系505个),仅有1%是mTSA,其余99%均来自未突变的基因序列。
进一步分析发现:超过50%的aeTSA为非经典类型,主要来源于基因间区、内含子和非编码RNA;TAA和LSA主要来源于可译框架(ORF),但黑色素瘤中的LSA在非编码RNA 和内含子衍生的MAP中也有富集;而mTSA虽来自经典编码区,但在两类癌症中都极为罕见。
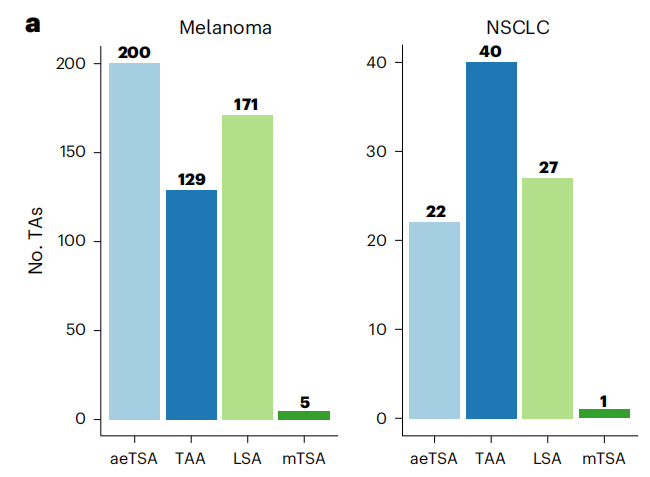
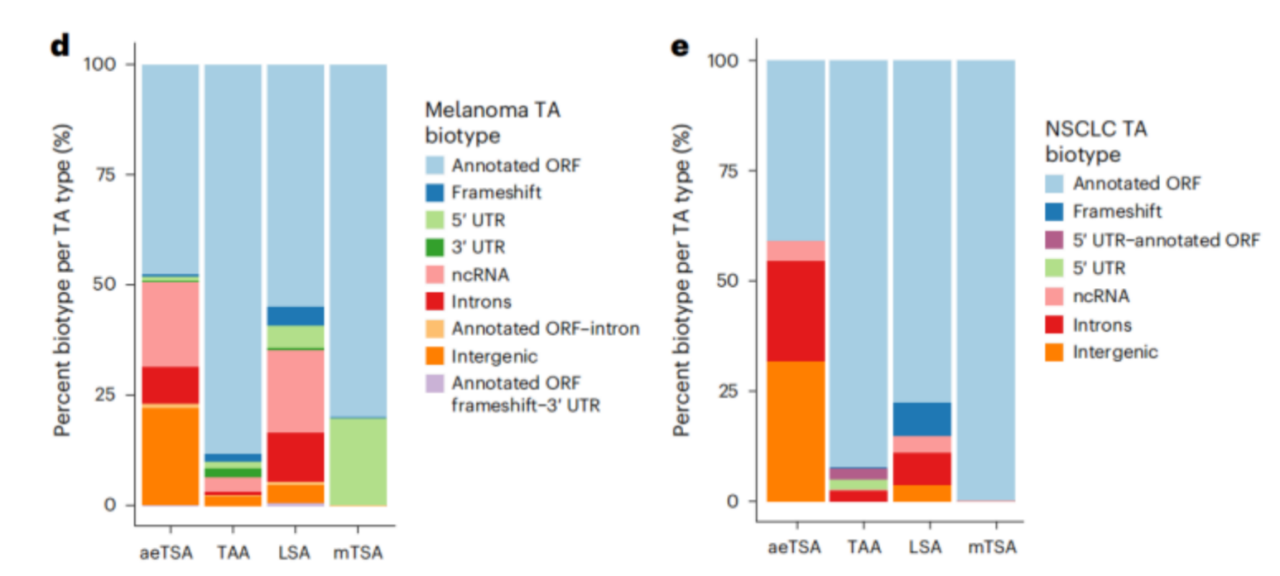
图1. 黑色素瘤和非小细胞肺癌中肿瘤抗原分析
那么,为何mTSAs的数量如此有限?研究发现,大多数mTSA的RNA转录丰度较低,而且大多不利于被MHC I类分子呈递的基因组区域,因此很少能被加工并呈递到细胞表面供免疫系统识别。
随后,研究人员将目光投向未突变的抗原(aeTSA、LSA和TAA),探究其在抗肿瘤免疫中的作用。他们分析预测了接受免疫检查点阻断(ICB)治疗(如anti-PD-1、anti-PD-L1、anti-CTLA治疗)前后肿瘤样本中的TA-HLA水平(与相应HLA分型匹配)。
结果显示:ICB治疗响应者(达到部分缓解或完全缓解的患者),其未突变TA-HLA的数量在治疗后显著减少;这一现象在无响应患者(即疾病稳定或进展的患者)中并未出现。此外,在响应患者中,aeTSA数量的减少与治疗期间扩增的T细胞克隆数量存在更强的线性相关性;相比之下,TAA和LSA与T细胞扩增之间虽呈正相关,但显著性较低。
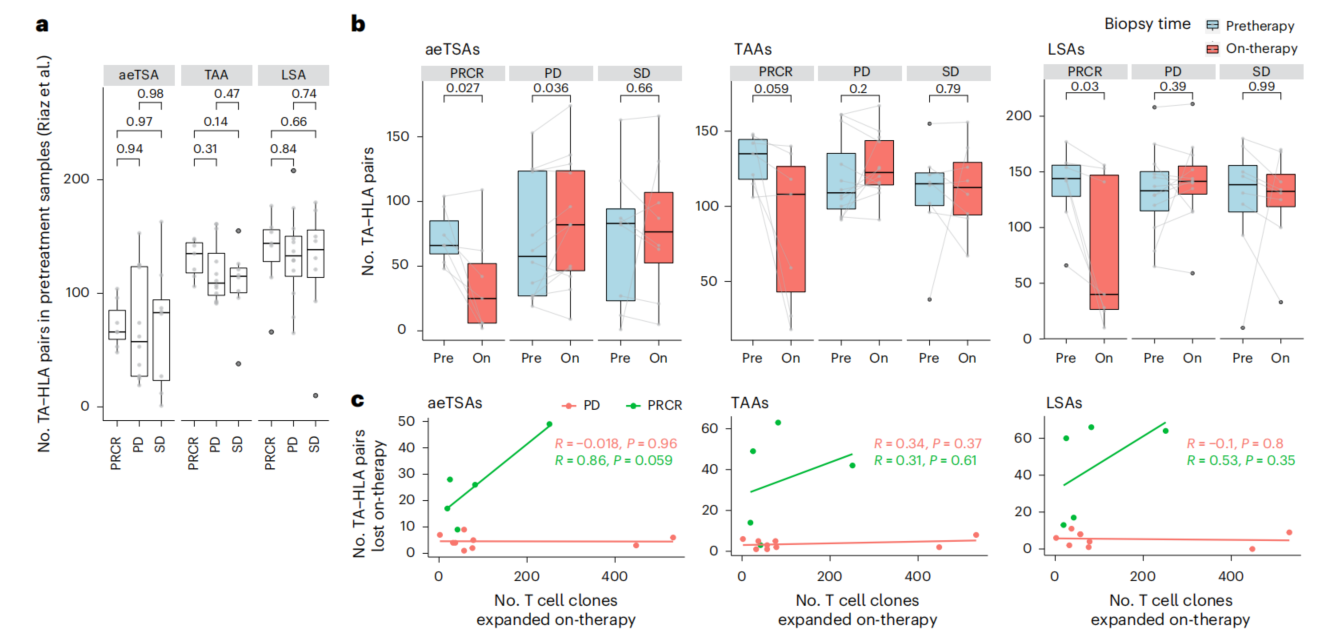
图2. aeTSAs与ICB响应相关
为评估aeTSA的免疫原性,研究人员进行了特异性T细胞功能扩增实验、细胞毒性实验、四聚体染色以及酶联免疫斑点检测(Elispot, IFN-γ+)。
结果显示:在黑色素瘤ICB响应患者治疗期间,多个发生显著变化的aeTSA都具有免疫原性,能够诱导多克隆T细胞扩增,并能够有效杀伤表达相应aeTSAs的肿瘤细胞。这些实验充分表明,aeTSA具有高度免疫原性,可介导对表达该抗原的肿瘤细胞的特异性杀伤。

图3. aeTSAs具有免疫原性
不仅如此,与mTSA相比,未突变肿瘤抗原还具有更好的共享性。这些抗原的出现与肿瘤细胞干性增加一致,许多共享的肿瘤抗原由癌胚(或癌症系)基因(aeTSA)和细胞周期基因(TAA)编码。这种在患者中具有的良好普适性,让未突变肿瘤抗原成为了理想的免疫治疗靶点。
该研究首次阐明了未突变肿瘤抗原,尤其是aeTSA在肿瘤免疫治疗中的作用,打破了人们对肿瘤抗原与免疫治疗响应关联的常规认知。这一发现对于以肿瘤抗原为靶点的肿瘤疫苗类药物而言,为其抗原的选择提供了全新的指引方向。
而在肿瘤疫苗的研发与评价过程中,可靠的动物模型和完善的服务体系是推动研究成果转化的关键。集萃药康自主研发的HLA人源化小鼠模型,通过精准模拟人类HLA分型及抗原呈递机制,可真实反映aeTSA、LSA等未突变抗原诱导的T细胞免疫应答;同时结合HLA人源化改造的肿瘤细胞系资源,能全面评估肿瘤疫苗在肿瘤发生、发展不同阶段的干预效果。在服务体系上,集萃药康提供从抗原筛选验证、疫苗免疫原性检测到体内抗肿瘤药效评价的一体化服务:通过流式细胞术、Elispot等技术监测T细胞激活及细胞因子分泌;结合肿瘤生长曲线与生存率分析,为肿瘤疫苗的临床前研发提供全面且贴近临床实际的评价数据,助力将未突变肿瘤抗原的研究突破转化为有效的治疗方案。

