Nature Microbiology | 延胡索酸点燃巨噬细胞抗病毒引擎:关键燃料AAS旁路揭秘
免疫细胞在活化、分化以及执行免疫功能时,会经历代谢重编程,能够使免疫系统对外部或内部的压力和刺激做出快速地响应与适应。作为先天免疫系统的关键组成部分,巨噬细胞通常依赖特定的代谢重编程发挥其在免疫应答中的功能。但其调节机制尚不清晰。延胡索酸能够通过琥珀酸化抑制肿瘤微环境中T细胞的激活与功能,阻止巨噬细胞焦亡,引起抗病毒反应,但其机制与来源仍是未解之谜。
清华大学江鹏团队在《Nature Microbiology》发表了题为“Metabolic remodelling produces fumarate via the aspartate-argininosuccinate shunt in macrophages as an antiviral defence”的文章。该研究采用了集萃药康Ass1-flox(C57BL/6JGpt-Ass1em1Cflox/Gpt,T009296)和Lyz2-icre(C57BL/6JGpt-Lyz2em1Cin(iCre)/Gpt, T003822)小鼠,报道了病毒感染引起的炎症导致巨噬细胞内尿素循环和三羧酸循环发生代谢重编程,形成天冬氨酸-精氨酸代琥珀酸(AAS)旁路的闭环代谢通路。该通路是巨噬细胞中延胡索酸的重要来源,在调控抗病毒先天免疫中起到重要作用,为代谢干预调节免疫功能提供潜在靶点。
病毒感染诱导巨噬细胞代谢重编程和延胡索酸积累
尿素循环的异常调节会促进肿瘤生长,增强巨噬细胞促炎功能。通过转录组和代谢组学分析发现,在水疱性口炎病毒(VSV)感染的巨噬细胞中,尿素循环的关键酶精氨琥珀酸合酶(ASS1)表达显著增加,促进延胡索酸的生成,提示病毒感染诱导了巨噬细胞代谢重编程,增强炎症信号传导。
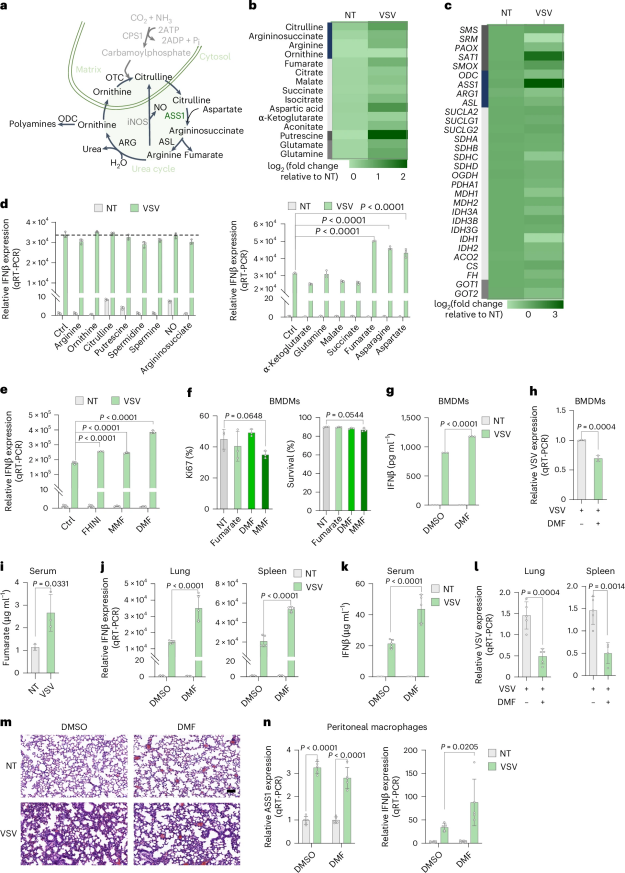
图1. 病毒感染导致代谢重编码和延胡索酸积累,增强抗病毒免疫反应。
AAS旁路生成延胡索酸的机制
在VSV感染早期,巨噬细胞线粒体内延胡索酸的水平几乎不变,但胞质内延胡索酸显著增加,而敲除Ass1将显著降低胞质内延胡索酸,表明可能存在新的代谢循环。研究团队利用同位素示踪法发现,当病毒感染巨噬细胞后,尿素循环和三羧酸循环由代谢重编程形成了新的通路,即天冬氨酸-精氨酸代琥珀酸(AAS)旁路,促进了由ASS1驱动的延胡索酸生成。敲除Ass1会显著降低细胞内延胡索酸水平,抑制IFN-β的表达,并削弱线粒体呼吸功能。
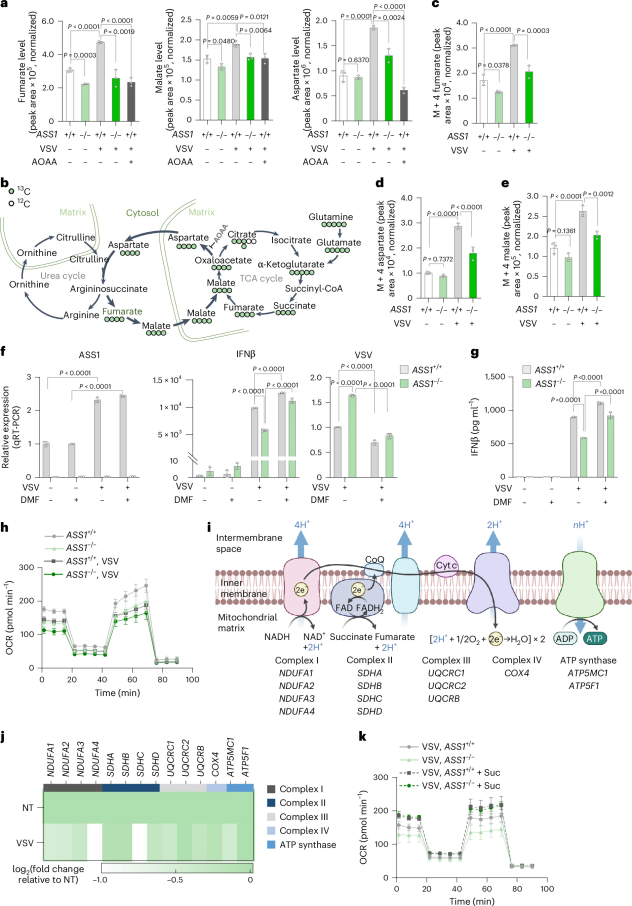
图2. 延胡索酸由ASS1驱动的AAS旁路产生
MAVS琥珀酸化促进病毒感染时IFN-β释放
研究团队进一步探究了延胡索酸的积累是如何增强抗病毒效果。RIG样受体(RLR)信号通路对宿主抵御病毒感染至关重要,能够激活RNA传感器RIG-I和干扰素诱导的解旋酶C结构域1(MDA5),招募线粒体抗病毒信号蛋白(MAVS),进而激活TBK1磷酸化,最终激活IRF3磷酸化,促进I型IFN的产生。当感染病毒后,巨噬细胞内TBK1与IRF3磷酸化增加,ASS1缺失导致磷酸化水平显著降低。利用延胡索酸的亲电性能够使其与蛋白质上的亲核半胱氨酸发生加成反应形成S-(2-琥珀酰基)-半胱氨酸(2SC)这一特性,研究团队发现延胡索酸在RIG-I下游发挥功能,促进MAVS在C46和C283处发生琥珀酸化并发生聚集,进而激活TBK1-IRF3通路,促进IFN-β的释放。
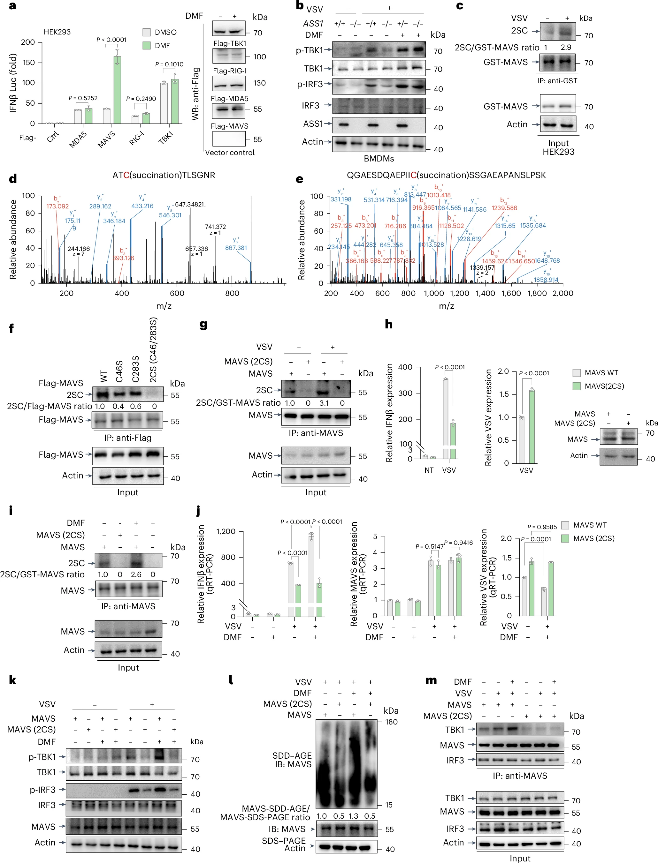
图3. 延胡索酸琥珀酸化MAVS以促进RLR信号通路和IFN释放
ASS1催化产生的延胡索酸促进RLR信号通路激活
研究团队随后也探究了其他RNA病毒感染过程中这一通路的变化情况,同样观察到感染后巨噬细胞中ASS1表达水平与延胡索酸水平的上升,MAVS琥珀酸化水平显著升高,IFN-β表达量增加。表明由ASS1驱动的延胡索酸诱导RLR信号通路可能是巨噬细胞响应RNA病毒感染的普遍通路。
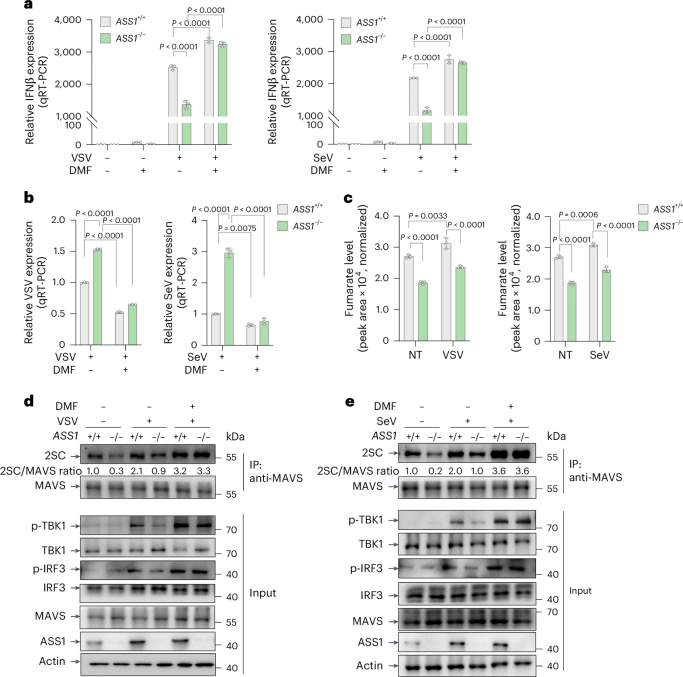
图4. ASS1的缺失限制人类巨噬细胞中延胡索酸产生和抗病毒RLR信号传导
ASS1驱动的延胡索酸增强先天性抗病毒免疫
研究团队发现在感染埃博拉病毒的患者的单核细胞中,ASS1表达显著上调,表明ASS1能够响应病毒感染信号,通过代谢重编程产生延胡索酸。而ASS1缺失的小鼠在病毒感染后则显现出干扰素应答受损的表型,表明ASS1驱动的延胡索酸能够增强体内的先天性抗病毒免疫。
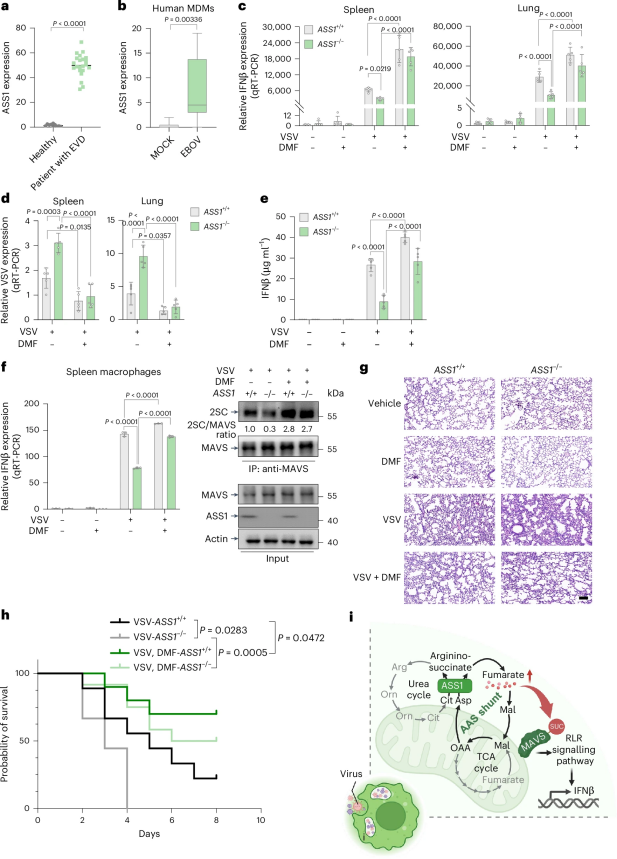
图5. ASS1驱动AAS旁路产生的延胡索酸增强先天抗病毒免疫应答
综上所述,该研究揭示了延胡索酸介导的先天性免疫机制以及病毒感染时延胡索酸的来源与调控机制。这些发现进一步证明了代谢重编程能够帮助细胞灵活抵御外界胁迫,赋予细胞新的功能。
参考文献
Nat Microbiol 10, 1115–1129 (2025).

