TCE药物临床前研发遇卡点?体内外验证数据给出解题思路
STEAP1 (Six-Transmembrane Epithelial Antigen of the Prostate 1 ) ,是STEAP家族成员之一,是一种定位于细胞膜表面的跨膜蛋白。其独特的拓扑结构包含6个跨膜结构域和可被抗体识别的胞外表位,在维持铁/铜离子稳态及细胞代谢过程中发挥关键作用。该蛋白最初在前列腺癌中被发现。研究证实,STEAP1在转移性去势抵抗性前列腺癌(mCRPC)、膀胱癌和非小细胞肺癌等多种侵袭性恶性肿瘤中呈选择性高表达,而在正常组织中表达显著受限。这种肿瘤特异性表达模式及其不良预后具有强相关性,这也确立了STEAP1作为精准免疫治疗理想靶标的潜力。
近年来,针对STEAP1的新型疗法呈现多元化发展趋势,主要涵盖抗体疗法、CAR-T细胞疗法及mRNA疫苗等领域。其中,由安进与百济神州联合开发的双特异性T细胞衔接器(TCE)AMG-509(Xaluritamig)占据着重要地位,作为全球首个进入临床试验的STEAP1靶向TCE药物,AMG-509采用创新的"2+1"靶向设计——即同时结合两个STEAP1表位与一个CD3分子,展现高亲和力及肿瘤选择性优势。该药物在mCRPC患者治疗中已显示出良好的初步疗效及安全性,并于2024年11月进入III期临床试验阶段,有望成为STEAP1靶向治疗领域的里程碑。目前,集萃药康已建立系统化的TCE药物评价平台,以STEAP1靶点为例,相关体内外验证数据梳理如下。
靶点表达验证
通过流式细胞术分析不同前列腺癌细胞系中STEAP1表达谱(图1),选用AMG-509及其二抗作为检测抗体,筛选出高表达靶点的细胞系模型。
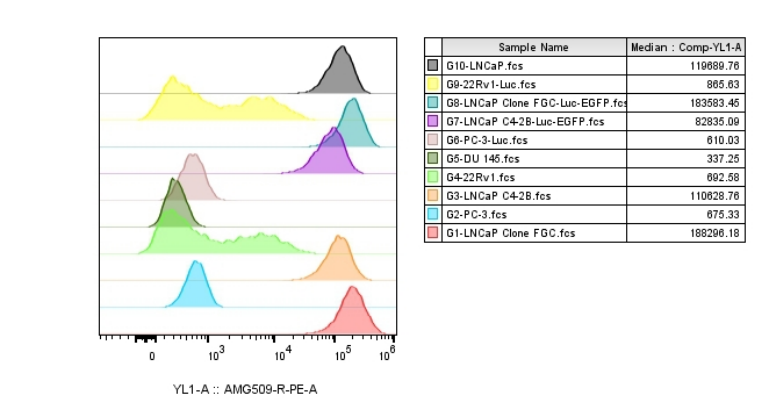
图1. 不同前列腺癌细胞系的STEAP1表达
体外杀伤评价
报告基因法
选取LNCaP Clone FGC-luc和LNCaP C4-2B-luc两种STEAP1高表达的荧光素酶标记细胞株,与不同比例的外周血单核细胞(PBMC)(效靶比10:1、5:1、2.5:1)共培养。使用梯度浓度AMG-509处理后,检测T细胞介导的细胞毒性(TDCC)。以未处理组为基准,利用相对发光单位(RLU)计算细胞毒性百分比。图2展示了本次实验的结果。
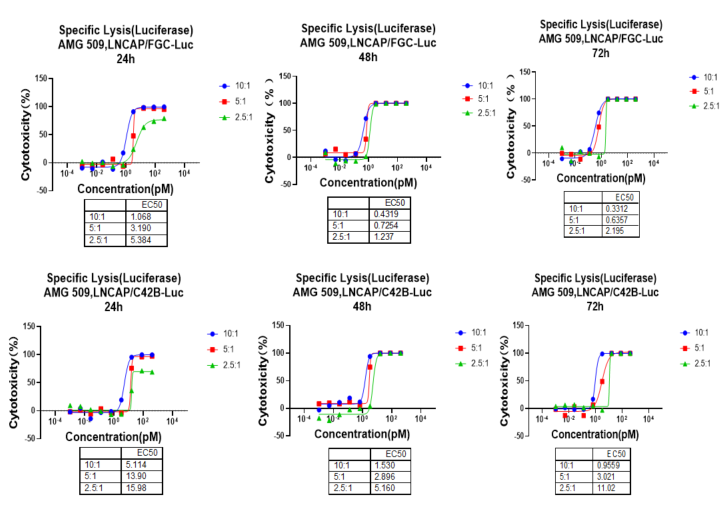
图2. AMG-509体外杀伤验证
上述结果显示,在一定范围内,TCE药物对靶细胞杀伤活性与效靶比和共孵育时间呈正相关。报告基因法可以有效评估TCE药物对靶细胞的杀伤效应,并具备高通量、宽动态范围等优势,更适用于早期筛选。在具体实验中,可以同步结合TCE药物的临床分子特性,选取相对应的条件体系进行体外药效评价。
抗体结合实验
抗体结合实验使用LNCaP Clone FGC和LNCaP C4-2B细胞系,与梯度浓度AMG-509共孵育后进行流式检测。以评价药物在STEAP1靶点端的结合情况。采用T淋巴细胞肿瘤细胞JurKat评价其在CD3端的结合情况。图3结果显示,AMG-509可剂量依赖性结合LNCaP Clone FGC及LNCaP C4-2B细胞表面STEAP1表位;同时,并且Jurkat细胞实验证实其对CD3表位的有效结合。
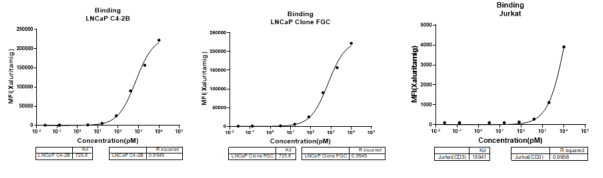
图3. AMG-509体外结合验证
体内药效验证
我们在NCG重度免疫缺陷小鼠模型中,移植STEAP1高表达肿瘤细胞(LNCap Clone FGC/LNCaP C4-2B)并重建人源PBMC免疫系统,进一步开展初步药效学评价。图4和图5为体内实验结果,AMG-509在两个细胞系模型(各使用两名供体PBMC)中均表现出显著抑瘤效果,验证了其体内抗肿瘤活性。
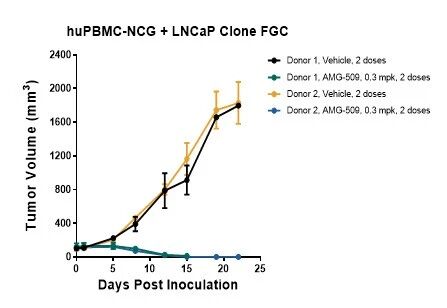
图4. AMG-509在LNCaP Clone FGC移植huPBMC-NCG模型中的体内药效学评价
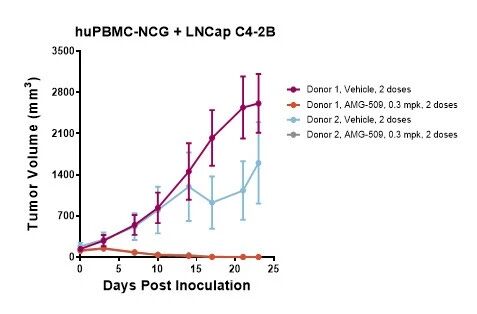
图5. AMG-509在LNCaP C4-2B移植huPBMC-NCG模型中的体内药效学评价
上述体内外实验数据验证了AMG-509作为靶向毒素治疗药物的潜力。
集萃药康基于成熟的分子与细胞实验和分析平台、高灵敏度流式检测技术及多样化肿瘤动物模型资源,构建了涵盖抗体偶联药物(ADC)、T细胞衔接器(TCE)、单克隆抗体及小分子抑制剂等各类药物的研发支持体系。该平台可为药物研发提供包括靶点验证、药效学评价和非GLP安全性评价等临床前研究,有助于深入解析药物作用机制、加速创新疗法开发,并为探索新型联合治疗策略提供核心驱动力,持续为肿瘤治疗领域注入新的可能。

