破局药物安全评价困境:人源化小鼠模型如何把风险控制在临床前?
在全球新药研发投入持续增长与监管标准日趋严苛的背景下,如何在非临床药物安全性评价中做好风险控制?以人源化小鼠模型为代表的实验室动物又发挥着什么作用?集萃药康带您深入了解。
动物模型和药物非临床安全性评价
实验室动物在药物非临床安全性评价中的应用需求正急剧攀升。据统计,全球每年有数千万只实验动物服务于新药筛选与毒理评估工作,其中啮齿类动物(特别是小鼠)的使用量占比超过70%[1]。这一需求增长趋势深刻反映了药物研发领域“早期发现、快速淘汰”的核心原则——尽早识别安全性问题,可显著降低后期临床试验阶段的高昂成本与失败风险。
药物安全性评价并非单一维度的试验,而是一套多层次、多维度的综合评估体系。其评价指标广泛涵盖一般毒性、生殖毒性、免疫原性、遗传毒性、致癌评价等多个关键领域,旨在全面、深入地揭示药物潜在的安全性特征,为药物研发决策提供科学依据。
随着精准医疗时代的到来,药物研发对临床前安全性评价提出了更为严苛的要求。在这一体系中,小鼠模型凭借其基因编辑技术成熟、繁殖周期短、饲养成本可控等诸多优势,已成为贯穿药物研发全流程的“核心工具”,在药物发现、靶点验证、药效评价及非临床安全性评估等各个环节发挥着不可替代的作用。
小鼠模型的核心应用场景
一、一般毒性评价
一般毒性评价作为药物非临床安全性评价的核心模块,是指通过实验动物进行不同途径、不同期限的染毒,综合检测各种毒性终点的实验。其核心目的在于通过动物实验,全面揭示外源化学物对机体的毒性作用特征。在实验动物的选择上,啮齿类动物,特别是小鼠,因其与人类基因组的高度同源性、4-6周的短繁殖周期以及强大的环境适应性等特性,而占据主导地位。
以hPD1/hCTLA4双靶点小鼠为例,基于C57BL/6-hPD1/hCTLA4与BALB/c-hPD1/hCTLA4小鼠分别进行的Anti-PD1与Anti-CTLA4联用毒副评价实验结果显示:
A. 如图1,CTLA4的Yervoy药物在临床试验过程中的数据显示临床病人出现明显的皮疹、肝炎、腹泻、结直肠炎等症状。BALB/c背景的hPD1/hCTLA4双靶点人源化小鼠在接受Yervoy和PD1抗体联合给药后出现明显的关节炎,皮疹脱毛等症状,而B6背景的小鼠未表现出明显的病理症状。
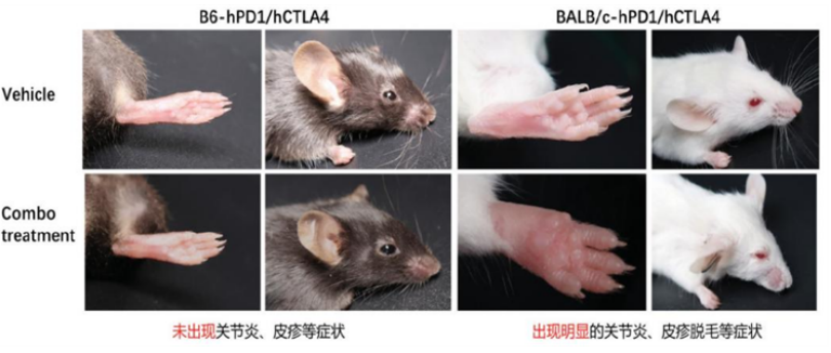
图1. hPD1/hCTLA4双靶点小鼠表型症状
B. 如图2,CTLA4靶点的Yervoy药物对小鼠心脏产生不同程度的炎症损伤,其中BALB/c小鼠心脏的炎症损伤程度较B6背景小鼠更为严重。
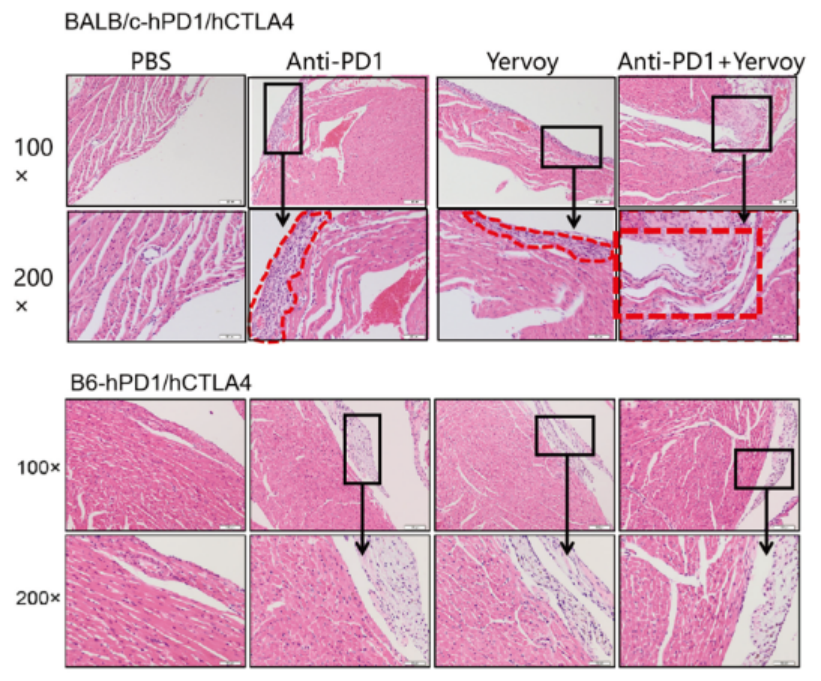
图2. hPD1/hCTLA4双靶点小鼠病理情况
上述实验结果表明,B6-hPD1/CTLA4背景小鼠模型对药物治疗具有耐受性;而BALB/c-hPD1/hCTLA4背景的免疫检查点人源化小鼠模型则能够重现临床中的一些不良反应,因此成为大分子、小分子药物临床前药物毒性评价的理想模型。
集萃药康小鼠已成功助力多家药企在药物申报过程中完成各种毒性评价:
复宏汉霖的HLX60(创新型抗GARP抗体)以B6-hLRRC32(GARP人源化小鼠模型)为基础,完成GLP毒理学实验,并成功申报IND。
瑞风生物的HBG基因修饰自体CD34+造血干细胞注射液利用NCG-X(第二代严重免疫缺陷小鼠模型)完成GLP毒理学实验,并成功申报IND。
二、生殖毒性评价
生殖毒性评价是药物非临床安全性评价的关键环节,其核心目的在于系统评估受试物对哺乳动物生殖系统可能产生的潜在危害。该评价体系涵盖了生殖细胞毒性、生殖器官损伤、生育力影响以及子代发育异常等多个重要维度。通过动物实验模拟人类生殖过程,旨在预测药物在临床应用中可能引发的生殖系统不良反应,为药物的安全性评价提供重要依据。
目前,大鼠因其生殖生理与人类高度相似且背景资料丰富,成为首选的啮齿类动物。而在生物制品的生殖毒性评价上,转基因小鼠模型则展现出了其独特的优势。以DBA-hIL17A小鼠为例,该模型通过基因编辑技术成功表达人源化白细胞介素17A受体,从而能够更精准地模拟人类免疫相关的生殖毒性反应。
DBA-hIL17A小鼠在助力生殖毒性评价方面,其优势主要体现在以下几个方面:
基因人源化优势:该模型成功表达了人源化IL17A基因,并经过基因和蛋白表达的严格验证,使得评价结果更具临床转化价值。
免疫功能完整性:DBA-hIL17A小鼠具有正常的免疫功能,其白细胞分类计数等指标均在正常范围内,这表明其免疫系统发育完善,能够真实反映药物对生殖系统免疫环境的影响。
繁殖性能稳定:该模型表现出良好的繁殖性能,包括每窝平均小鼠数、精子活力和胚胎移植出生率等指标,均与常规小鼠品系相当,确保了实验结果的可靠性。
药理反应相关性:在CIA关节炎模型中,DBA-hIL17A小鼠表现出稳定的药效反应,这为评估药物对生殖系统的全身性影响提供了重要参考。
实验流程与技术支持:实验流程严谨高效,从冷冻胚胎的复苏、基因型鉴定到小鼠的繁殖和交付,每一步都经过精心设计,确保了实验结果的可靠性和可重复性。完善的技术支持材料也为研究者提供了全面的实验指导。
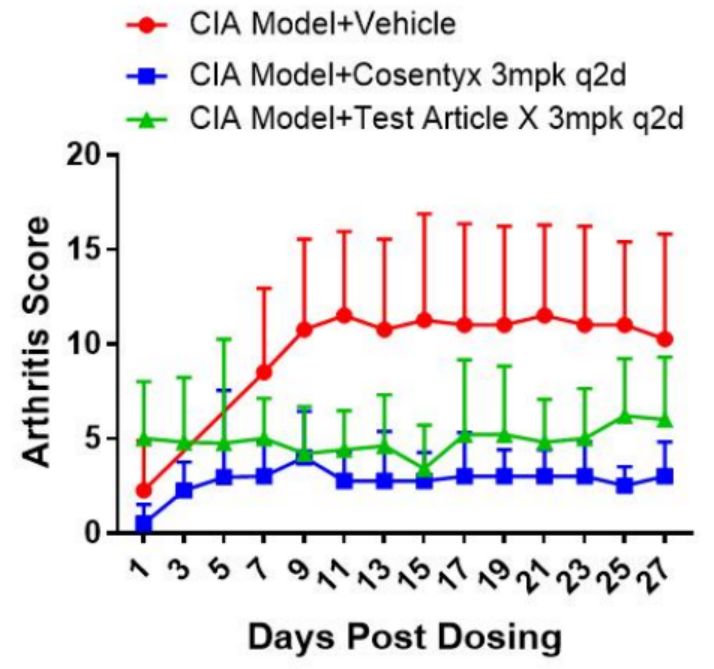
图3. DBA-hIL17A关节炎模型药效验证数据。数据以Mean±SD展示。
如图3,使用II型胶原蛋白配合弗氏佐剂诱导DBA-hIL17A小鼠产生关节炎,并使用拮抗IL-17A的市售药物苏金单抗(Cosentyx)以及靶向IL-17A的测试药物X进行治疗,结果显示DBA-hIL17A小鼠关节炎模型可以有效响应靶向人源IL17A的药物,这进一步验证了该模型在药物评价中的准确性和可靠性。集萃药康已基于该小鼠模型完成生殖毒性评价实践,验证了其在药物安全性评估中的实际应用价值。
三、致癌性评价
致癌性评估试验旨在通过系统检测受试药物对实验动物可能引发的癌变效应,科学评估其转化为人体长期用药后潜在的致癌风险,现已成为药物研发流程中非临床安全性评价体系的核心组成部分。
相较于大鼠、犬、猴等其他实验动物,小鼠在致癌性评价中具有繁殖周期短、成本可控、数据积累丰富等不可替代的优势。1997年ICH S1B指南提出“2年大鼠实验+6个月转基因小鼠实验”的模式,先后获得美国FDA、欧盟、日本厚生省等国际监管机构与组织的广泛认可与采纳[2]。在目前开发出的新模型和方法中,rasH2转基因小鼠因其同时适用于遗传毒性和非遗传毒性的致癌物检测,且使用范围更广,被公认为进行快速致癌性测试的理想动物模型。该模型的主要优势包括:
1. 实验周期显著缩短
2. 实验动物用量减少
3. 试验体系可控性增强
集萃药康通过将人Hras基因转入B6小鼠体内,以转基因方式成功培育出Hras转基因小鼠。通过将转基因雄性小鼠与BALB/c雌鼠杂交,最终获得了F1代,即BALB/c; B6J-Tg(hHRAS)16/Gpt品系。实验表明,Hras小鼠的致癌敏感性与rasH2相似,可应用于为期六个月的致癌性评估研究中。该模型为药物开发过程中候选化合物致癌性风险的评估提供了一种更高效、更直观且经济性更优的解决方案。
通过非基因毒性和基因毒性致癌物检测,部分验证数据如下:
A. 如图4,体重数据结果显示,Hras小鼠在接受MNU致癌物刺激后,其体重与对照组相比,于D98出现显著下降。
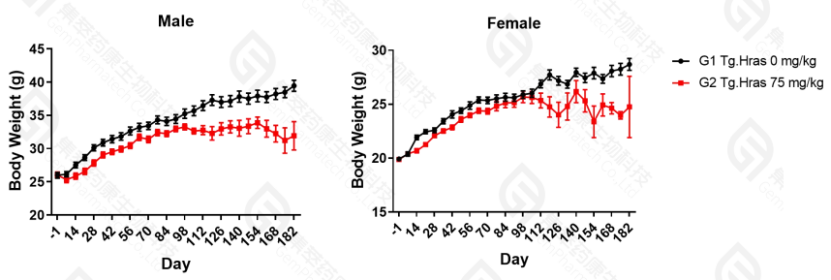
图4. 致癌性评价试验各组小鼠体重
B. 如图5,生存曲线结果显示,Hras小鼠在接受75mg/kg MNU致癌物刺激后,出现大量小鼠死亡。
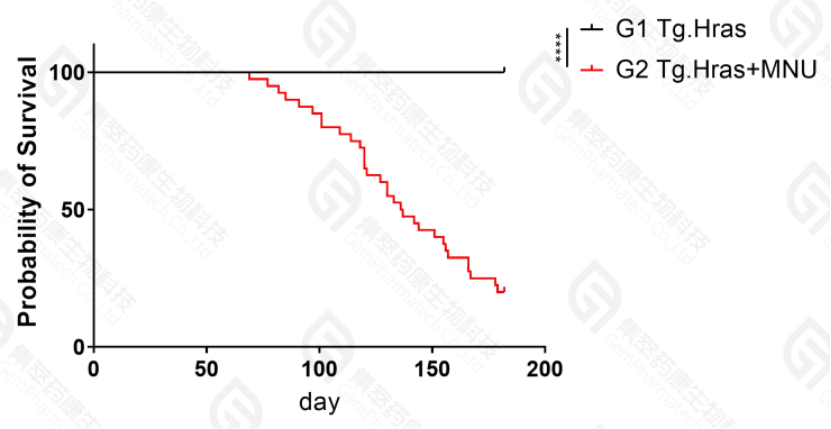
图5. 致癌性评价试验各组小鼠生存曲线
C. 对死亡小鼠及终点安乐死小鼠进行剖检,并取材各脏器进行HE染色及病理阅片,结果显示:在75mg/kg MNU刺激下,Hras小鼠均有肿瘤发生,且肿瘤类型多样,发病器官涵盖淋巴、胃、肺、皮肤等多个组织;而G1 Vehicle组仅有1例小鼠出现纤维肉瘤。
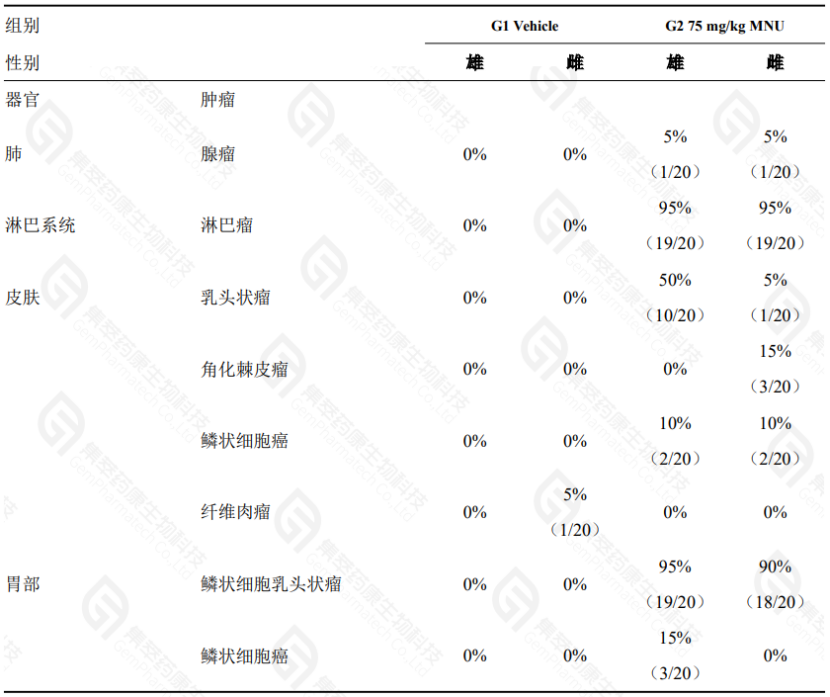
以上结果充分表明,BALB/c; B6J-Tg(hHRAS)16/Gpt品系对MNU的敏感性较高,该品系可作为致癌性评价实验的理想模型。
四、免疫原性评价
免疫原性试验是药物非临床安全性评价的核心组成部分,其核心目标在于评估药物诱导机体产生免疫应答的能力,包括抗体生成和细胞免疫应答。在实验动物的选择上,免疫缺陷小鼠因其能够接受人源免疫细胞移植并模拟人类免疫应答的特性,已成为该领域的重要研究模型。
为研究肿瘤疫苗的免疫原性评价,研究团队利用NCG小鼠成功构建了DC-HIS模型[3]。该模型通过密度梯度离心法分离人外周血单核细胞,并与体外诱导分化的同源树突状细胞(DCs)进行共移植,从而构建出更接近人类免疫细胞组成比例的活体模型。
应用该模型对靶向HER2蛋白疫苗(NitraTh-HER2)进行免疫原性评价时,取得了显著成果。如图6,DC-HIS小鼠模型能够全面评价肿瘤疫苗的免疫原性。具体而言,NitraTh-HER2疫苗在DC-HIS小鼠中成功诱导了HER2特异性人IgG抗体的产生,并展现出显著的抗体依赖的细胞介导的细胞毒性作用(ADCC),靶细胞SK-BR-3的裂解率达到47.1%。此外,该疫苗还能够产生抗原特异性的CTL效应,靶细胞SK-BR-3的裂解率达到14.6%。
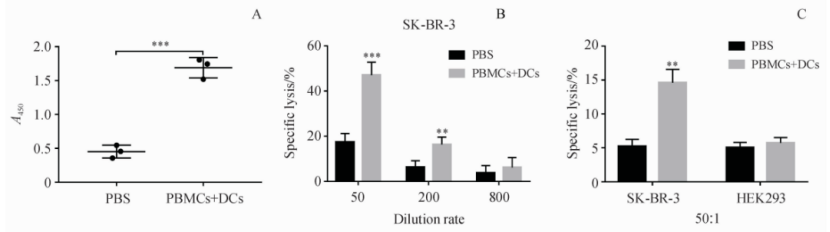
图6. DC-HIS小鼠可以全面评估癌症疫苗的免疫原性(Mean±SD, n=3)
DC-HIS小鼠用NitraTh-HER2进行免疫。每周收集血清。(A) 第21天小鼠血清中HER2特异性人IgG的浓度。(B,C) 第28天收集脾细胞。采用常规4小时LDH释放法测定ADCC和CTL对肿瘤细胞的裂解作用。
**P<0.01,***P<0.001(与PBS组比较)
上述实验结果证实,DC-HIS模型能够精准复现人类免疫系统对肿瘤疫苗的应答特征。集萃药康NCG小鼠的重度免疫缺陷背景为共移植细胞提供了无竞争的发育环境,而人源免疫细胞的植入则确保了评价体系的物种相关性;该模型为预测肿瘤疫苗的临床疗效及安全性提供了重要支持,展现出独特的优势。
“药筛鼠”精准赋能药物安全性评价
在非临床安全性评估体系中,动物种属的合理选择对于预测药物临床风险具有至关重要的价值。针对生物制剂研发领域,ICH S6《生物制品临床前安全性评价技术指南》明确指出:在缺乏相关种属的情况下,应优先考虑搭载人类受体基因的转基因动物模型或采用同源蛋白进行非临床安全性评估[4]。这一原则直接指向了“药筛鼠”计划的核心技术逻辑——即通过人源化改造来破解种属差异所带来的难题。
集萃药康基于BALB/c和C57BL/6两种背景品系,成功启动了“药筛鼠”计划。该计划开发出了一系列具有自主知识产权的药物靶点人源化小鼠模型,包括单靶点、双靶点及三靶点等多种类型。这些模型已广泛覆盖肿瘤、免疫、代谢心血管、神经等多个疾病领域,为药物研发及安全性评价提供了理想的动物模型。以下是部分代表性模型一览:
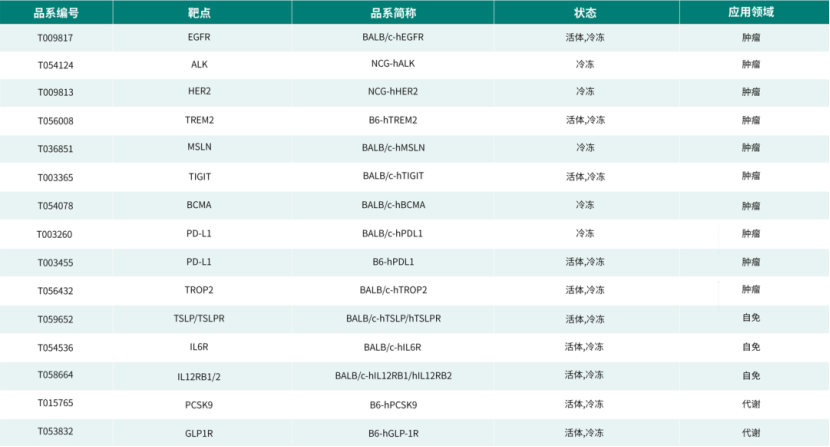
如需了解更多人源化小鼠品系详情,欢迎发送邮件至marketing@gempharmatech.com咨询!
参考文献
[1]https://www.rspca.org.uk/documents/1494935/9042554/The+use+of+animals+in+toxicity+testing+-+an+RSPCA+information+paper+%282010%29.pdf/19ef8ff4-127d-aa7f-0960-c13b3c5ece56?t=1553171379597
[2]https://database.ich.org/sites/default/files/S1BR1_FinalGuideline_2022_0719.pdf
[3]China Pharm Univ. 2019;50(6):734 -742.
[4]https://database.ich.org/sites/default/files/S6_R1_Guideline_0.pdf

