破局STING耐药:解锁单核细胞「内源PD-L1」靶向抗癌新路径

2025年3月10日,中国复旦大学附属华山医院消化病研究所刘杰和骆菲菲团队在《Cancer Cell》上发表重要研究论文“Targeting tumor monocyte-intrinsic PD-L1 by rewiring STING signaling and enhancing STING agonist therapy”。该研究首次揭示了STING激动剂诱导单核细胞内源性PD-L1介导免疫抑制的全新机制,并创新性地提出通过重编程STING信号信号通路以提升治疗疗效的策略。研究使用的C57BL/6JGpt (品系编号:N000013), BALB/cJGpt (品系编号:N000020), Sting1-KO (品系编号:T012747)与Irf3-KO (品系编号:T013849) 小鼠模型来源于集萃药康。
研究背景
干扰素基因刺激因子(STING)通路在抗癌免疫中扮演着复杂的“双刃剑”角色。一方面,它在启动针对病原体和肿瘤的免疫应答中至关重要,STING激动剂在临床前模型模型中展现出巨大潜力;然而,临床试验中单一STING激动剂疗法疗效有限,肿瘤常表现出抵抗性;甚至新兴证据表明STING通路可能在某些情况下促进肿瘤进展。其中,PD-L1被视为关键的负向调控因子。PD-L1在肿瘤微环境(TME)中的过表达,通过与PD-1结合抑制抗肿瘤免疫。尽管PD-1/PD-L1阻断联合STING激动剂的策略优于单药治疗,但总体应答率仍有待提高。
研究结果
宿主细胞内源性PD-L1 决定STING激动剂的抗肿瘤疗效
为了阐明PD-L1在STING激动剂抗肿瘤效应中的作用,研究团队利用CRISPR-Cas9技术构建了B16F10黑色素瘤细胞PD-L1敲除株及宿主全身性PD-L1敲除小鼠(Cd274-KO),并结合双侧肿瘤模型进行研究。在野生型小鼠中,仅敲除肿瘤细胞PD-L1对DMXAA(一种STING激动剂)的疗效无显著影响。而在Cd274-KO宿主小鼠中,DMXAA治疗展现出更显著的肿瘤抑制作用。在双侧肿瘤模型中,局部注射DMXAA不仅能控制注射部位的肿瘤,还能诱导远处(非注射侧)肿瘤消退;联合应用PD-L1阻断抗体可进一步增强DMXAA引起的远处抗肿瘤效应。这些突破性发现表明,宿主PD-L1可能并非仅仅通过与PD-1的外在结合来发挥作用,而是通过其细胞内在抑制功能,在更深层次上削弱了STING介导的抗肿瘤免疫。
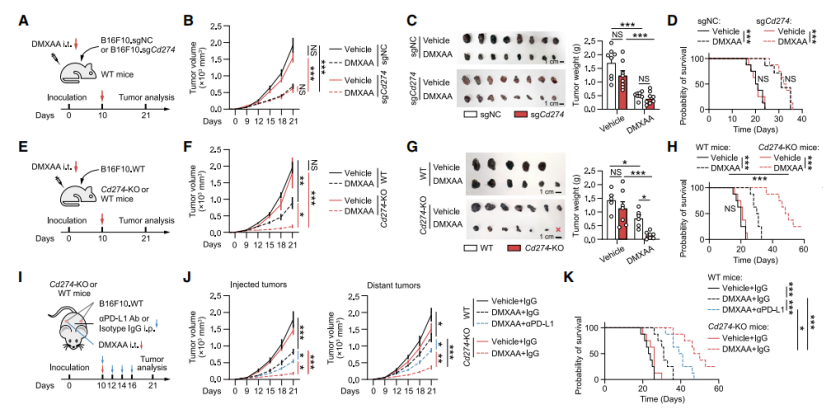
图1. 宿主细胞内源性PD-L1消融增强STING激动剂的抗肿瘤作用。
STING激活通过肿瘤单核细胞中PD-L1驱动免疫抑制
通过流式细胞术、体外实验及单细胞RNA测序(scRNA-seq)分析等多种手段,研究团队发现STING激活后,肿瘤微环境中髓系细胞,特别是肿瘤单核细胞(Tu.Mons)成为PD-L1的主要来源。多种STING激动剂可直接上调单核细胞的PD-L1表达,对人类黑色素瘤的数据分析也支持这一结论。此外,PD-L1过表达会损害CD8+T细胞(CTLs)功能,且STING激动剂治疗会增加肿瘤内CTLs的耗竭程度。这些结果揭示了STING激活与PD-L1表达及肿瘤免疫抑制性微环境之间的紧密关联。
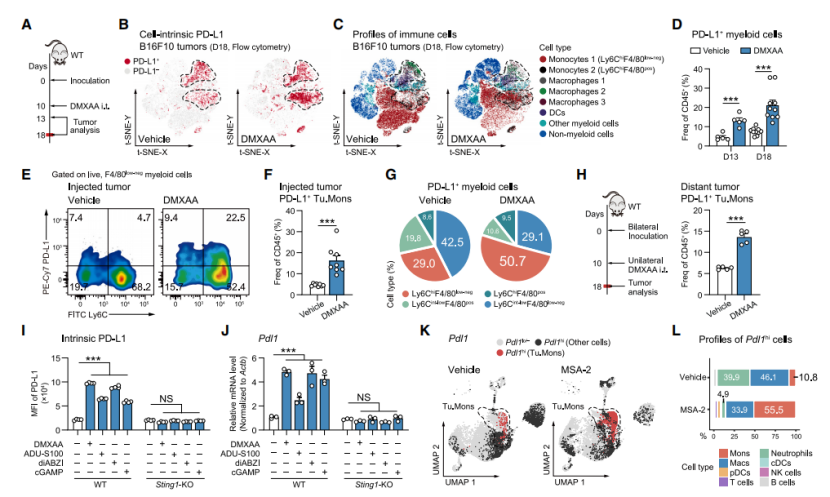
图2. STING激活可增加肿瘤单核细胞中PD-L1的表达
STING诱导的内源性PD-L1驱动肿瘤单核细胞的促肿瘤特性及STING激动剂的耐药性
研究深入探讨了PD-L1⁺ Tu.Mons在肿瘤进展和STING激动剂耐药中的作用。分析黑色素瘤单细胞数据发现,有转移患者单核细胞 PD-L1 表达显著高于无转移者,提示其促肿瘤潜力。通过体内特异性耗竭Ly6C+单核细胞,研究观察到肿瘤生长受到抑制,STING激动剂DMXAA的抗肿瘤效果增强,同时效应性CD8+T细胞频率增加。这些结果表明Tu.Mons不仅可能促进肿瘤进展,还是机体对STING激动剂疗法产生耐药性的重要因素。进一步实验揭示,造成这种STING诱导的Tu.Mons免疫抑制功能的关键因素在于其细胞内在的PD-L1表达,而非仅其细胞表面PD-L1。具体而言,当将肿瘤细胞植入乏单核细胞趋化关键分子CCR2(Ccr2-KO) 的小鼠,并通过过继转移向小鼠提供敲除了Cd274基因(编码PD-L1)的单核细胞(Cd274-KO)时,相比于接受野生型单核细胞的小鼠,其对DMXAA治疗的反应更佳,表现为效应性CD8+T细胞浸润显著增多。这清楚地证实,单核细胞中由STING通路诱导的内源性PD-L1是损害STING激动剂抗肿瘤疗效的核心机制。
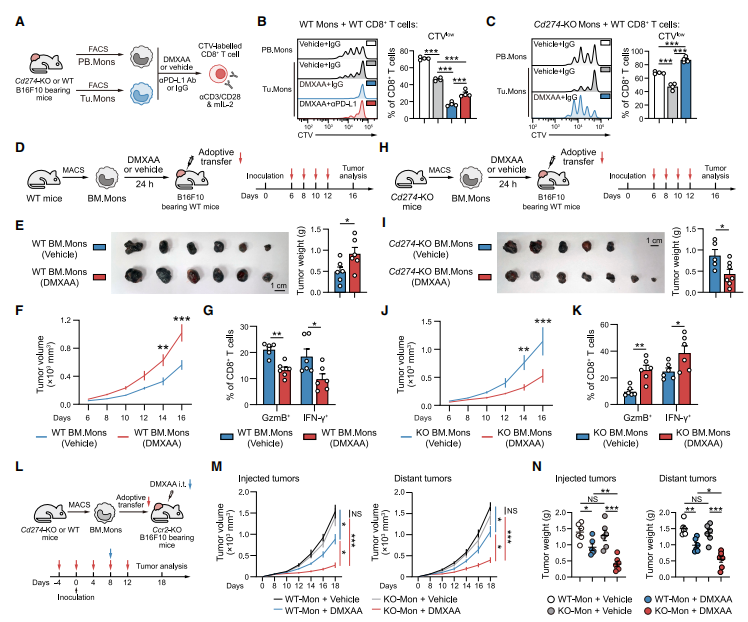
图3. STING诱导的内源PD-L1驱动肿瘤单核细胞的促肿瘤特性及肿瘤对STING激活的耐药性
STING通过 IFN-I-IFNAR 轴诱导肿瘤单核细胞内源 PD-L1 表达
鉴于STING诱导的细胞内源性PD-L1对Tu.Mons 促肿瘤特性的重要作用,研究团队进一步探究了PD-L1上调的机制。通过比较经STING激动剂DMXAA 处理的荷瘤小鼠不同单核细胞(WT PD-L1hi/lo/–Tu.Mons、WT PB.Mons 等)的mRNA表达谱,探究PD-L1上调机制。发现WT PD-L1hiTu.Mons与其他组转录特征差异明显,其促肿瘤相关基因表达更高,且能抑制CD8⁺T细胞增殖。对人类癌症泛癌队列的生存分析显示,PD-L1hiTu.Mons特征评分高的患者死亡风险高,PD-L1lo/–预后好,这些发现表明,STING诱导的PD-L1hi和PD-L1lo/–Tu.Mons在人类癌症进展中发挥着截然不同的作用。进一步探究驱动STING诱导Tu.Mons中PD-L1过表达的效应,通过GSEA等分析发现,STING介导的IFN-I自分泌反应是主要驱动因素,而非NF-κB激活,因为IFNAR阻断可降低 PD-L1 表达,而TNF-α和IL-6阻断无此效果,且Ifnar1或Irf3缺陷时PD-L1上调受抑制。
TLR2激活的肿瘤单核细胞对STING诱导的内源PD-L1上调及促肿瘤特性具有抗性
研究发现,PD-L1低表达/缺失和Cd274基因敲除的Tu.Mons在STING激活后,呈现TLR和NF-κB激活特征却无促肿瘤表型,且STING诱导的PD-L1上调在相关细胞重新暴露于 DMXAA时明显受损。RNA-seq和scRNA-seq分析表明,单核细胞中TLR2等基因高表达,且TLR1、TLR2等在髓系细胞共表达,TCGA分析显示TLR1和TLR2预测多种癌症有利预后。
基于此,研究假设合成TLR2-TLR1激动剂Pam3CSK4可拮抗STING诱导的PD-L1表达。体内外实验表明,Pam3CSK4预处理能降低STING激动剂诱导的PD-L1上调。体内实验还显示,Pam3CSK4预处理后注射 DMXAA,可降低髓系细胞等内源PD-L1表达,且TLR2激活“训练”能通过下调Tu.Mons 内在PD-L1表达,拮抗STING诱导的促肿瘤活性。
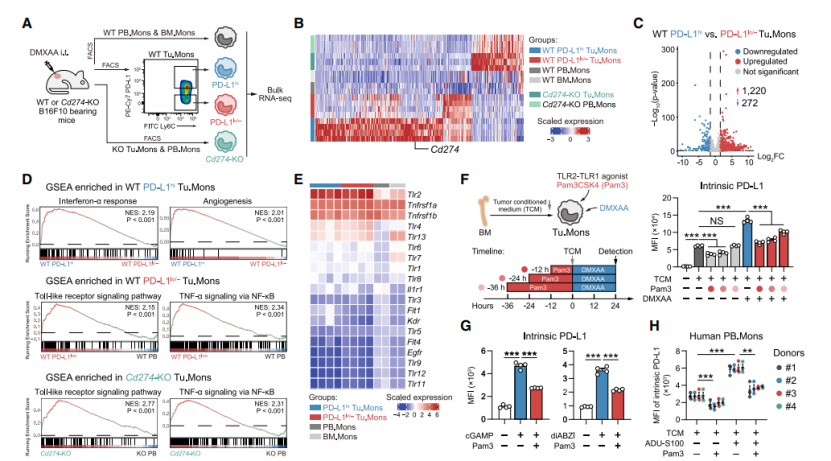
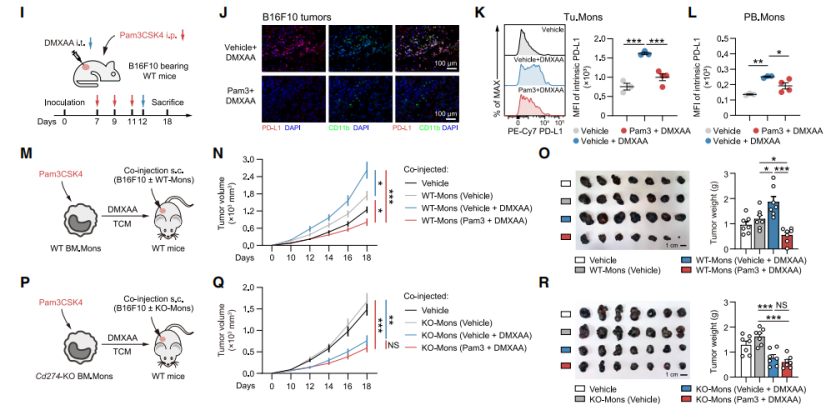
图4. TLR2 预激活可改善STING诱导的肿瘤单核细胞内源PD-L1上调及促肿瘤活性
TLR2预激活通过促进TRAF6-STING相互作用重塑STING信号通路以降低肿瘤单核细胞内源PD-L1表达
通过批量RNA测序分析发现,Pam3CSK4预处理使多个基因表达下调,包括Cd274及促肿瘤基因等,且抑制了“干扰素-α反应”和“JAK-STAT信号通路”。进一步研究表明,Pam3CSK4预处理抑制IFN-I产生,进而降低PD-L1水平,且该过程依赖IFNAR。此外,TLR2预激活不影响STING诱导的树突状细胞活化。生化分析显示,Pam3CSK4预处理降低IRF3磷酸化,增强NF-κB激活,促进TRAF6-STING复合物组装及STING的K63连接泛素化,使反应从IFN-I激活转向NF-κB激活。在Traf6基因敲除细胞中,Pam3CSK4预处理无法降低PD-L1和IFNB1表达。这些发现为理解TLR2信号通路在调节STING介导的免疫反应中的作用提供了新见解。
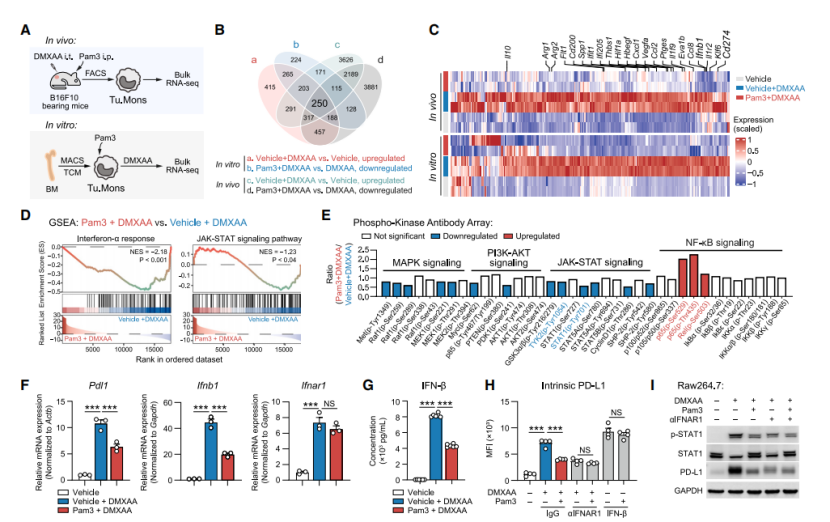
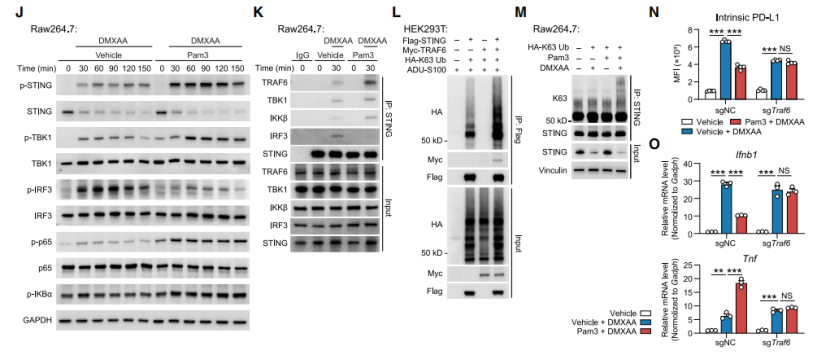
图5. TLR2预激活促进TRAF6-STING结合抑制STING-IFN-I-IFNAR1-STAT1轴,降低细胞内源PD-L1
STING激动剂与TLR2激动剂协同作用增强抗肿瘤疗效
在多种小鼠癌症模型中,TLR2激动剂Pam3CSK4与STING 激动剂DMXAA 联合,较单药或联合抗 PD-L1 抗体,能更有效减小肿瘤体积与重量、延长生存期,还可重塑肿瘤微环境,增加CD8+T细胞等免疫细胞浸润,降低PD-L1表达。在人类相关研究中,泛癌种分析、TCGA数据集分析显示TLR2信号或可增强STING介导的抗肿瘤反应。进一步用人A375黑色素瘤细胞系构建人源化免疫功能正常小鼠模型,发现Pam3CSK4和ADU-S100序贯联合治疗,对肿瘤生长抑制作用更强,能降低肿瘤相关单核细胞内源PD-L1,增加 CD8+T细胞,表明二者协同可增强抗肿瘤疗效。
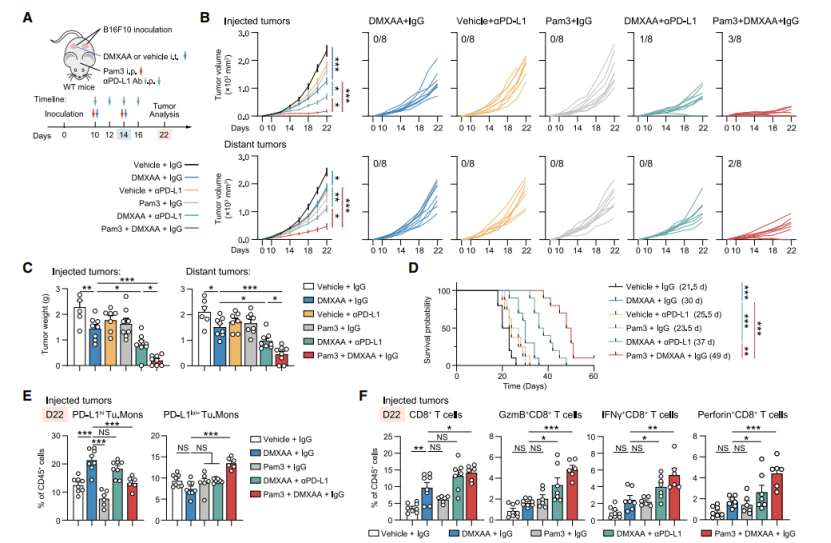
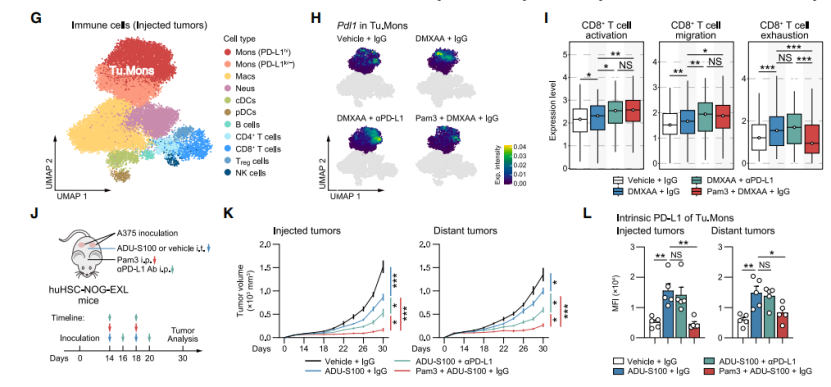
图6. STING激动剂疗法与TLR2激动剂预处理联合使用可增强全身抗肿瘤疗效
结论
STING作为启动免疫应答的关键DNA感应机制,其靶向疗法在临床试验中效果未达预期。本研究发现,STING信号通路会诱导产生PD-L1高表达的肿瘤单核细胞(PD-L1hiTu.Mons),这些细胞主导了机体对 STING 激动剂疗法的抵抗。具体而言,STING - IRF3 - I型干扰素(IFN-I)轴诱导的细胞内源PD-L1,是促肿瘤PD-L1hiTu.Mons产生的驱动因素。
值得注意的是,TLR2激活的肿瘤单核细胞能够抵抗STING诱导的细胞内源性PD-L1表达上调及相关的促肿瘤功能。
该研究不仅揭示了由细胞内源性PD-L1介导的STING激活促肿瘤新机制,并通过重编程 STING 信号输出(微调)来增强抗肿瘤免疫力。

