全球首个双抗ADC成功!集萃药康EGFR/HER3靶点全资源解析
2025年7月,医药界迎来里程碑时刻!百利天恒自主研发的EGFR×HER3双抗ADC药物BL-B01D1,在治疗局部晚期或转移性鼻咽癌的III期临床中达成主要终点,成为全球首个完成III期研究的双抗ADC药物。这一突破不仅验证了双靶点ADC的潜力,更标志着肿瘤治疗进入精准靶向新时代。
EGFR×HER3:双靶点ADC的破局之路
表皮生长因子受体(epidermal growth factor receptor, EGFR)是一种膜结合的酪氨酸激酶受体,属于四个密切相关受体亚家族HER1/EGFR/ERBB1, HER2/NEU/ERBB2, HER3/ERBB3, HER4/ERBB4之一[1]。EGFR可促进肿瘤的增殖,增加肿瘤细胞的存活,在肿瘤的发生和发展中起重要作用。EGFR在多种人类恶性肿瘤中高表达,如40%~80%肺癌、14%~91%乳腺癌、33%~74%胃癌、40%~80%前列腺癌及36%~100%的头颈部肿瘤等[2]。EGFR表达水平越高,恶性程度越高,预后越差,因而成为重要的肿瘤治疗靶分子。
HER3(又称ERBB3)是EGFR家族的重要成员,通过PI3K/Akt、MAPK和JAK/STAT等信号通路促进细胞增殖、存活和分化[3]。正常生理条件下,HER3参与组织发育和体内平衡;然而,HER3产生的异常信号传导也与多种癌症有关,包括乳腺癌、卵巢癌、前列腺癌和胃癌等。并且,研究发现包括>80%的EGFR突变型非小细胞肺癌在内的大多数肺癌都表达HER3[4]。
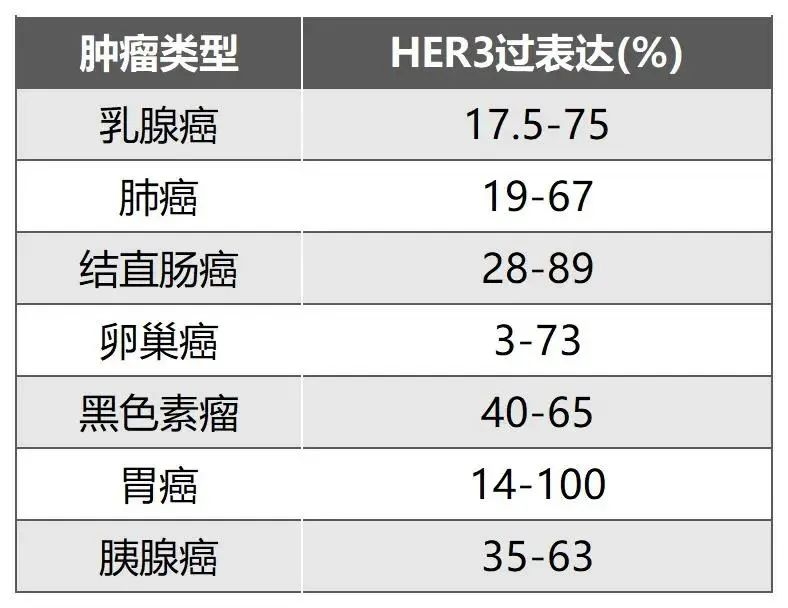
不同肿瘤类型中HER3过表达的发生率[5]
BL-B01D1通过EGFR/HER3双特异性抗体精准锁定肿瘤细胞,结合高药抗比(DAR=8)的拓扑异构酶I抑制剂,实现“精准打击+高效杀伤”的双重机制。其I期数据(ORR 45.8%,DCR 100%)已展现卓越抗肿瘤活性,而III期成功更预示其可能成为鼻咽癌、肺癌、乳腺癌等多癌种的一线治疗新选择。
EGFR/HER3双抗ADC[6]
集萃药康:EGFR/HER3靶点模型资源全覆盖
作为创新药研发的坚实后盾,集萃药康已布局针对EGFR/HER3靶点的全链条模型资源,助力ADC等靶向药物研发。
1. 药效评价
EGFR/HER3作为肿瘤治疗的重要靶点,其靶向药物(如ADC药物、小分子靶向药)的疗效评估需要建立可靠的临床前研究体系。然而,传统动物模型往往难以准确模拟人类肿瘤微环境及药物作用机制,导致临床转化率较低。为解决这一关键问题,集萃药康建立了多层次的药效评价平台:
异种移植模型
CDX模型是将人源的肿瘤细胞移植到小鼠的皮下,精准模拟肿瘤细胞表面EGFR/HER3的表达特征,可用于ADC药物(抗体偶联药物)的体内药效评价,通过不同抗原表达水平的细胞系验证ADC药物的疗效。
PDX模型通过直接移植患者肿瘤组织,保留肿瘤异质性及EGFR/HER3表达特征,能更好地预测药物的临床疗效。
集萃药康PDX模型药效案例:
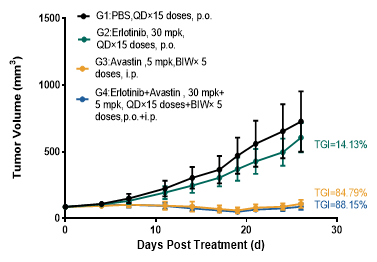
Erlotinib(EGFR拮抗剂)的PDX药效验证
CDX和PDX模型两者结合构建了从靶点验证到临床前疗效预测的完整药效评价体系,可为EGFR/HER3靶向药物的开发提供关键决策依据。
通过在免疫重建后的NCG小鼠上接种含EGFR/HER3靶点的人源肿瘤细胞/组织,可形成“人源免疫系统+人源肿瘤”的双人源化模型,进一步助力精准免疫协同效应评估。
同系模型(Syngenic model)
通过将含EGFR/HER3靶点的人源化鼠源肿瘤细胞系移植到同系的免疫健全小鼠体内,同系模型可为人类肿瘤免疫治疗药物的药效学研究提供重要的移植物资源。这类模型由于具有完整的免疫系统,可以应用于肿瘤靶向药物联合免疫治疗的评估。
集萃药康部分同系细胞系成瘤验证数据
(A)CT26-hHER2(Tg)-mErbb3(mHer3)(KO)-hERBB3(hHER3)(Tg)在BALB/c皮下接种模型中肿瘤生长曲线;
(B)CT26-hHER2(Tg)-mErbb3(mHer3)(KO)-hERBB3(hHER3)(Tg)在BALB/c皮下接种模型中小鼠体重变化(n=6)
(A)4T1-hEGFR(Tg)-mEGFR(KO)在BALB/c皮下接种模型中肿瘤生长曲线;
(B)4T1-hEGFR(Tg)-mEGFR(KO)在BALB/c皮下接种模型中小鼠体重变化(n=6)
2. 安全性评价
EGFR作为肿瘤免疫疗法中的核心靶标,其靶向治疗(如ADC药物及双特异性抗体)已在临床中展现出显著疗效。然而,由于EGFR在皮肤、胃肠道等正常组织中广泛表达,此类疗法首先会引发靶向毒性(如皮肤毒性、胃肠道毒性等);此外还可能诱发细胞因子释放综合征(CRS)、神经毒性等免疫相关不良反应,这些安全性问题严重限制了其临床应用范围。为解决这一痛点,集萃药康提供了两类创新动物模型:
NCG-hEGFR人源化模型(T009811)
通过基因编辑技术,将NCG小鼠的鼠源EGFR基因信号肽及胞外区精准替换为人源EGFR对应片段。结合CDX/PDX肿瘤移植,该模型可高度模拟人体内靶向EGFR药物的作用机制,成为评估EGFR靶点药物安全性的理想工具。
集萃药康免疫缺陷药靶人源化小鼠验证数据:
如图,在杂合的NCG-hEGFR和NCG小鼠中检测到鼠源EGFR mRNA表达,而人源EGFR仅在人源化小鼠中检测到。
人源EGFR mRNA水平在NCG-hEGFR人源化小鼠中的表达检测
BALB/c-hEGFR人源化模型(T009817)
宿主免疫系统健全:通过基因编辑技术将免疫健全BALB/c小鼠EGFR信号肽及胞外区置换为人源片段,在保留免疫系统功能的同时实现靶点人源化。
ADC药物开发关键平台:为抗体偶联药物(ADC)的抗体部分提供临床前免疫安全性及有效性评估的一体化解决方案。
集萃药康免疫健全药靶人源化小鼠验证数据:
如图,在BALB/c-hEGFR小鼠中检测到人源EGFR表达。雄性和雌性小鼠的EGFR表达水平存在差异,与先前的报道一致。
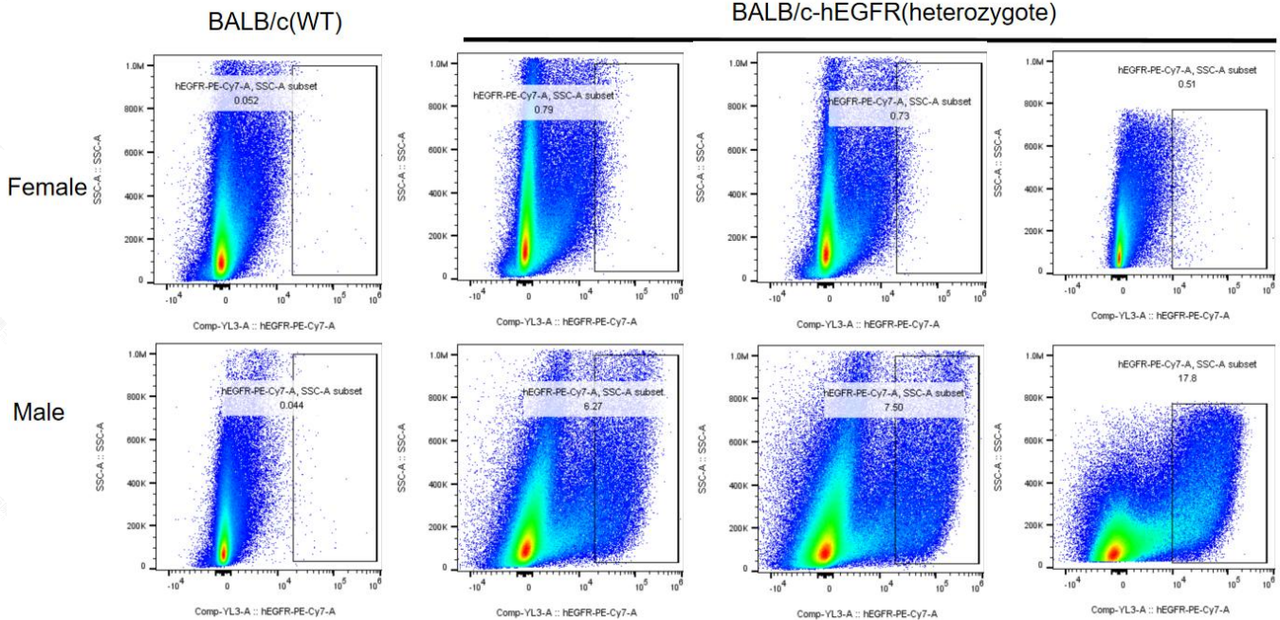
通过流式细胞分析检测BALB/c-hEGFR人源化小鼠中人源EGFR表达
此外,针对HER3靶点的BALB/c-hHER3人源化模型(T064891)也在研发中,可用于精准评估以HER3为靶点的ADC药物的抗肿瘤活性和安全性。
相关模型资源
部分细胞系来源的异种移植瘤模型(CDX模型)
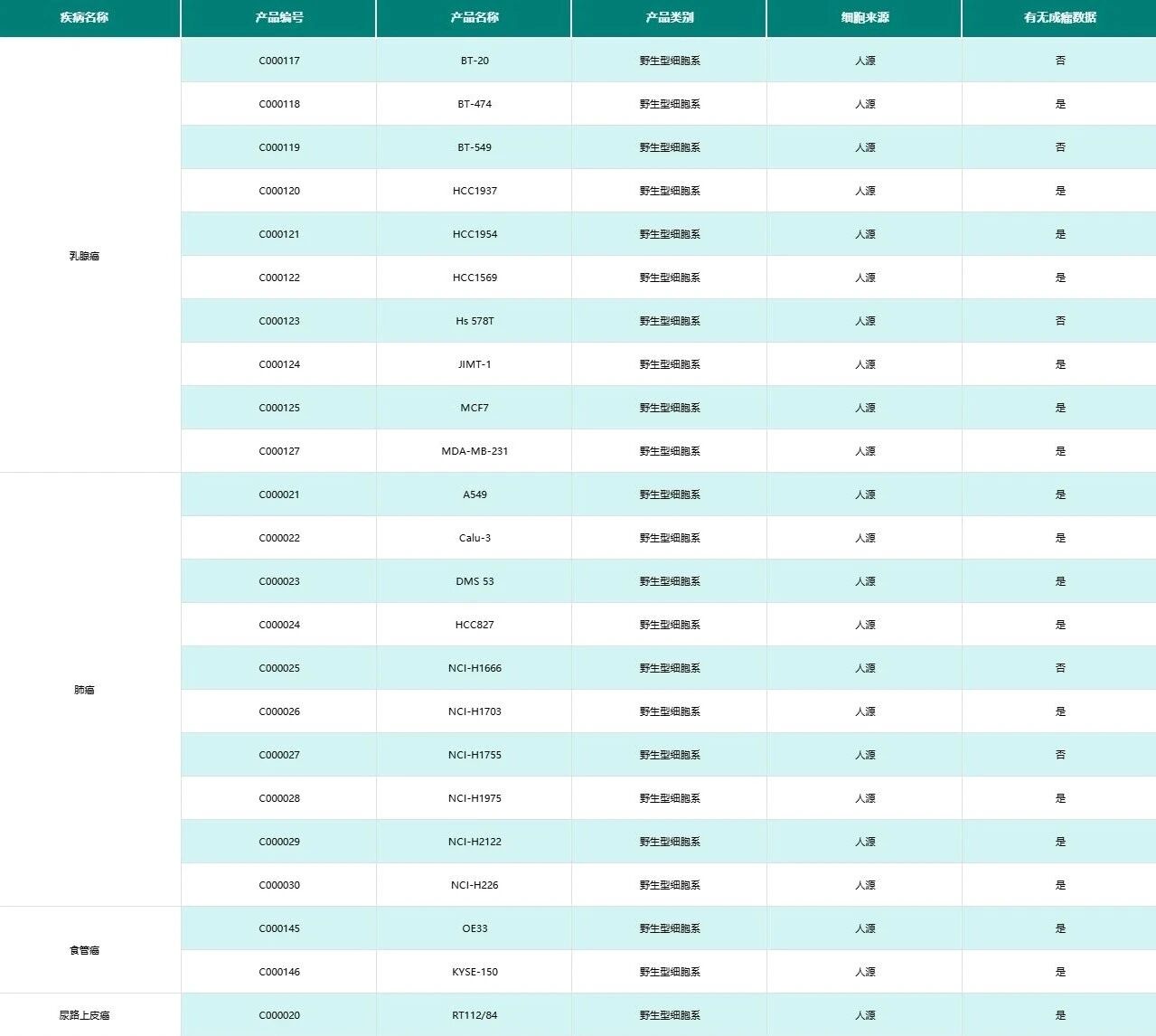
部分人源肿瘤组织异种移植瘤模型(PDX模型)

部分EGFR/HER3靶点人源化细胞系资源
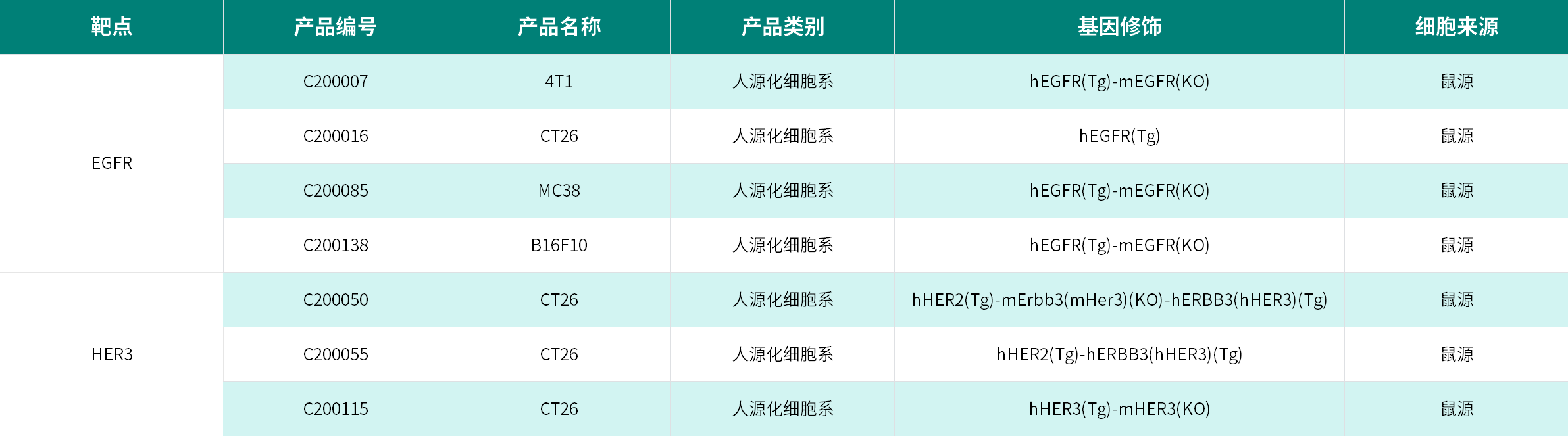
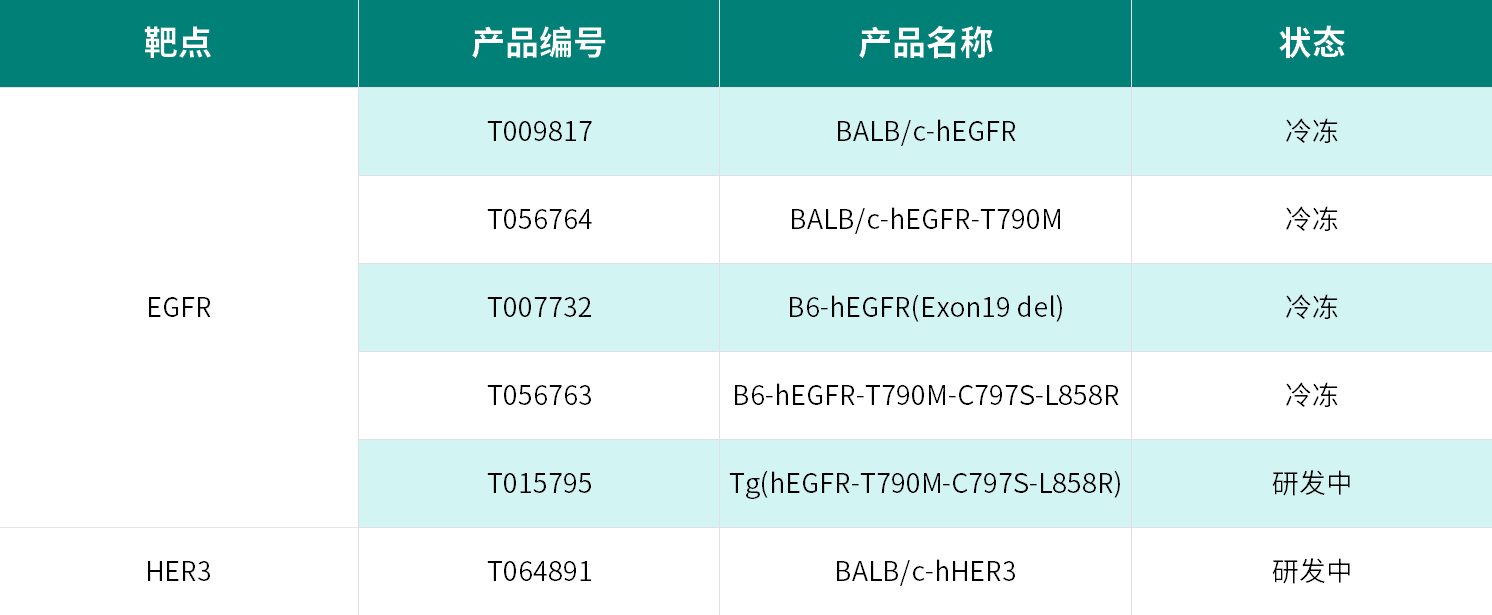
部分EGFR/HER3靶点人源化小鼠模型
参考文献
[1]Clin Cancer Res. 2006 Jan 112(1):183-90.
[2]Chin JMAP, 2012 April, Vol.29 No.4.
[3]https://cn.sinobiological.com/category/ads/her3-cancer-immunotherapy
[4]https://memoinoncology.com/egfr%E7%AA%81%E5%8F%98%E6%9D%A1%E4%BB%B6%E4%B8%8B%E7%9A%84%E7%89%B9%E5%AE%9A%E6%B2%BB%E7%96%97%E6%96%B9%E6%B3%95/
[5]Cancer gene therapy 15.7 (2008): 413-448.
[6]Zang et al. ASCO 2024.
[7]https://mp.weixin.qq.com/s/IvbC95QZkBaBgTX12t7WAw

