咸鱼大翻身——病理标志物Amylin胰淀素是如何变成减肥药新宠?
1986年,科学家在研究2型糖尿病患者的胰腺组织时,意外发现了一种特殊的淀粉样沉积物。这种被命名为Amylin(胰淀素,又称胰岛淀粉样多肽IAPP)的物质,最初被认为是导致β细胞损伤的"罪魁祸首"。然而随着深入研究,科学家们逐渐揭开了它的双重身份——既是糖尿病进展的帮凶,又是调控能量代谢的关键激素。
35年后的今天,Amylin已成为代谢疾病治疗领域的热点之一,其类似物在肥胖治疗中展现出惊人的效果。最新临床研究显示,新型Amylin受体激动剂与GLP-1药物的联用方案,减肥效果甚至超越当前主流药物。本文将带您深入了解这一神奇分子的前世今生。
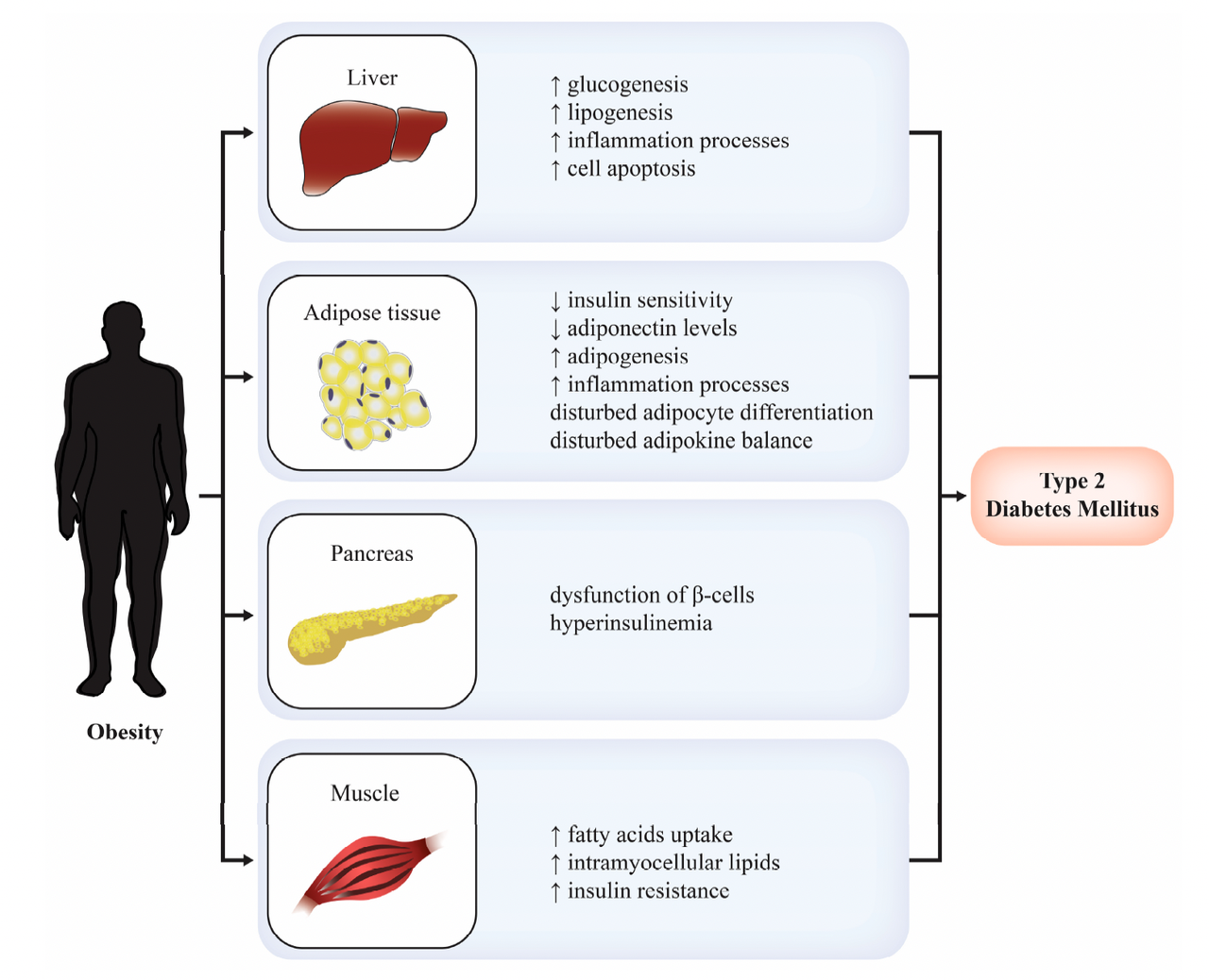
图1. 肥胖与2型糖尿病之间的病理生理联系[1]
Amylin的生物学特性与作用机制
结构特征与分泌调控
Amylin是由37个氨基酸组成的肽类激素,与胰岛素共同储存在胰腺β细胞的分泌颗粒中。在血糖升高时,两者以1:100的比例协同分泌。其受体由降钙素受体(CTR)与受体活性修饰蛋白(RAMP)组成异源二聚体,形成AMY1-3三种亚型,其中AMY3与食欲调控关系最为密切。
生理与病理的"双面性"
致病机制:在人类、灵长类和猫科动物中,Amylin易发生错误折叠形成β片层结构,聚积为淀粉样纤维。这些沉积物通过诱发内质网应激、线粒体功能障碍等机制,加速β细胞凋亡[2]。
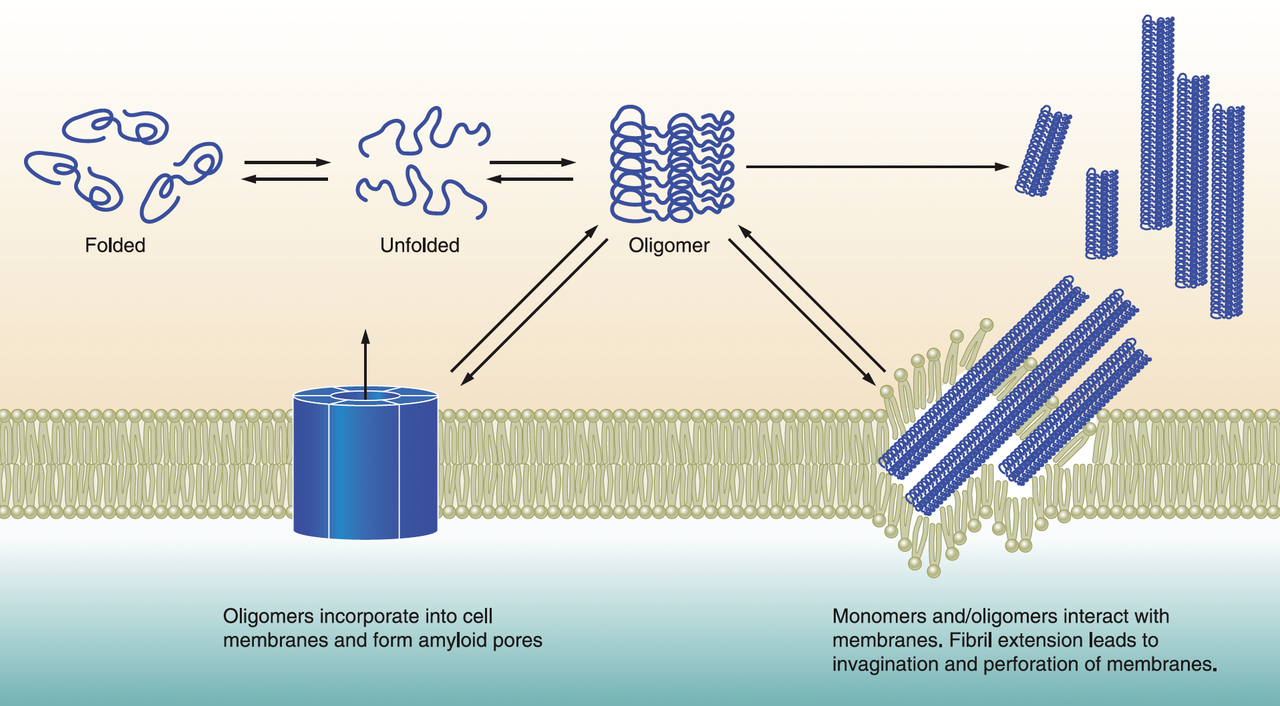
图2. Amylin错误折叠聚集后可能导致细胞膜损伤,引发细胞毒性过程[2]
治疗机制:可溶性单体Amylin作为循环激素,能通过血脑屏障作用于脑干最后区(AP),产生以下效应:
延缓胃排空(约40-50%)
抑制胰高血糖素分泌
增强瘦素敏感性
减少食物摄入量(约15-20%)
Amylin类药物发展历史
第一代药物:普兰林肽的诞生
1995年,科学家通过脯氨酸替换解决了人Amylin易聚集的问题,开发出首个稳定类似物普兰林肽(Pramlintide)。2005年,FDA批准其用于糖尿病治疗,临床发现其不仅能降低糖化血红蛋白(HbA1c)0.5-1.0%,还能平均减重1.5-3.5kg。然而,普兰林肽半衰期仅30-50分钟,需每日3次注射,且单独使用减重效果有限。直到2008年,Roth团队发现Amylin能通过下丘脑ARC核团增强瘦素受体表达,从而改善肥胖个体的"瘦素抵抗"。临床试验显示,普兰林肽与瘦素类似物metreleptin联用20周后,患者平均减重达12.7%,体脂下降显著[3]。
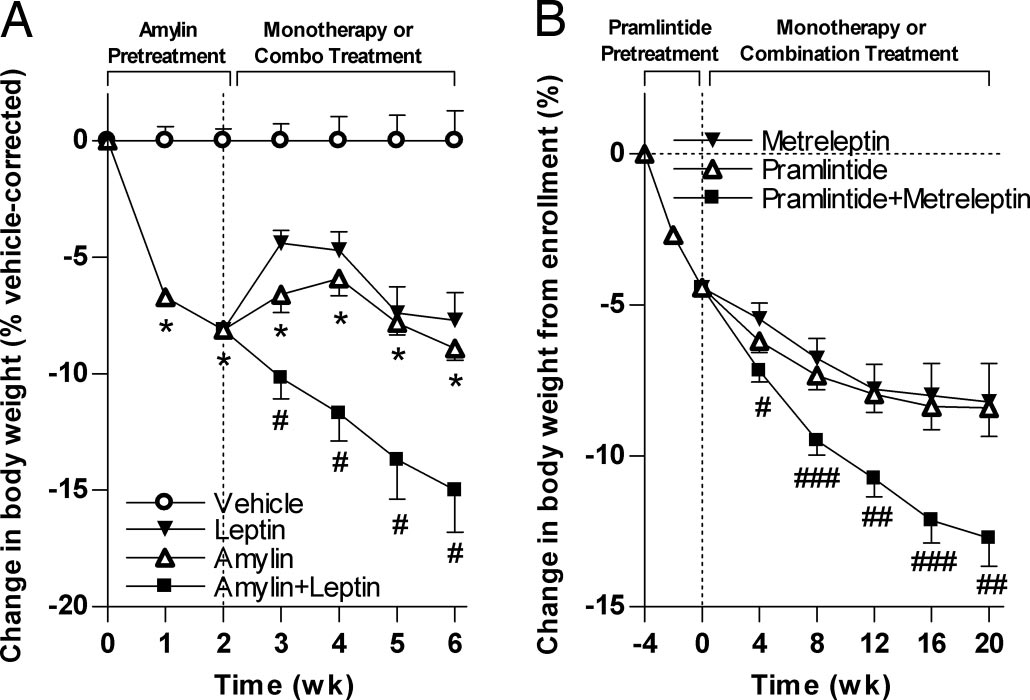
图3. 胰淀素和瘦素联合激动剂对DIO大鼠(A)和超重/肥胖人类(B)的减重效果[3]
新一代药物:长效制剂
近年来,新一代Amylin类药物取得重大突破。AM833(Cagrilintide)通过PEG化修饰将半衰期延长至6-8天,仅需每周1次皮下注射。Ⅱ期临床结果显示,单用16周减重10.8%,与GLP-1激动剂司美格鲁肽联用后减重效果提升至17.1%[4]。
Amylin类药物的作用机制
Amylin的减肥机制涉及复杂的中枢神经调控网络。外周Amylin激活脑干最后区(AP)神经元后,通过谷氨酸能投射激活外侧臂旁核(LPBN),最终增强下丘脑POMC神经元活性并抑制AgRP/NPY神经元,同时降低伏隔核多巴胺释放,减少食物奖赏效应。在外周代谢方面,Amylin可延缓胃排空达50分钟,抑制餐后胰高血糖素升高幅度达60%,并促进白色脂肪褐变。与GLP-1药物相比,Amylin的信号通路具有互补性——GLP-1主要作用于孤束核(NTS),而Amylin主导AP的神经调控,这使得两者联用能产生1+1>2的协同效应。
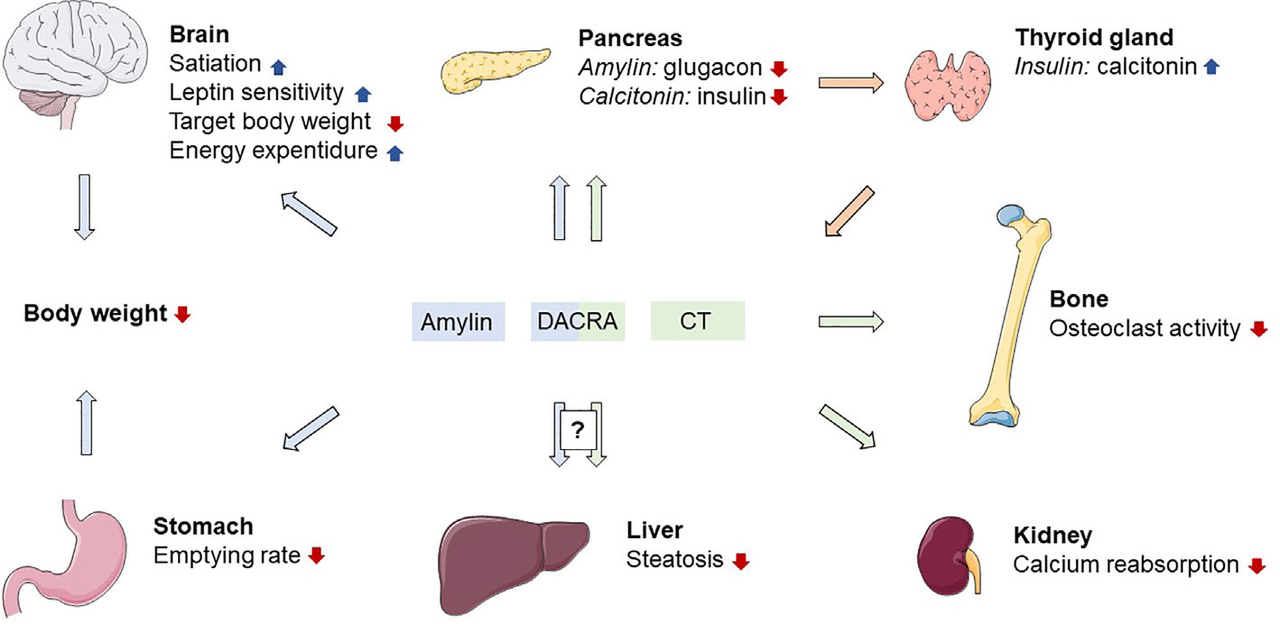
图4. 胰淀素和降钙素受体激活的相关生理作用[5]
Amylin类药物的药效验证
研究表明,Amylin类药物在减重方面效果显著,但其药物研发仍需经历漫长的转化过程,其中动物模型验证是不可或缺的环节。虽然小鼠是药物研发中最常用的动物模型,但实验证明,对于Amylin类药物的验证,大鼠比小鼠更具优势。
数据显示,大鼠和小鼠对Amylin类药物的反应存在明显差异。大鼠能实现持续的体重减轻,与人类临床试验结果一致,而小鼠仅表现出短暂的摄食抑制,缺乏长期减重效果。这种差异源于大鼠NTS(孤束核)中的Calcr/Prlh神经元能被药物长期激活,表现为Prlh表达显著上调;而小鼠的同源神经元因Calcr表达水平低且缺乏RAMP3,无法形成功能性受体复合物[6]。
值得注意的是,大鼠DVC(背侧迷走复合体)的细胞分布和Prlh信号通路特征与人类更为相似,和非人灵长类的对比研究也证实了这一保守性。因此,大鼠模型能更准确地预测Amylin类药物的临床效果,其神经机制和药效反应与人类更具可比性,是研究这类药物的理想临床前模型[6]。
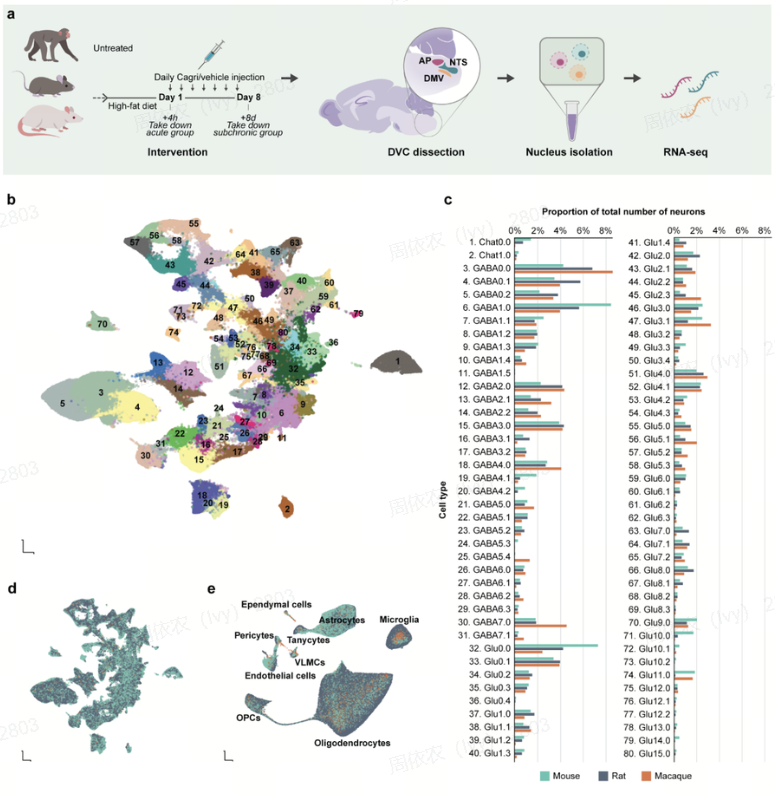
图5. DVC单细胞转录组跨物种图谱(大鼠、小鼠、非人灵长类动物对比)[6]
集萃药康DIO大鼠Amylin药效验证服务
实验动物模型作为药效验证的基础,其质量关系到项目的成败。作为国内实验动物行业的龙头企业,集萃药康为行业提供基于高质量DIO大鼠的Amylin药效验证服务,可以提供现货DIO大鼠为客户省去大鼠模型的诱导构建时间,相比于从头诱导构建节省6~8周的项目时间。同时集萃药康丰富的基于动物模型的项目经验能够为客户提供实验方案的优化,提高项目成功率,为新药研发申报保驾护航。
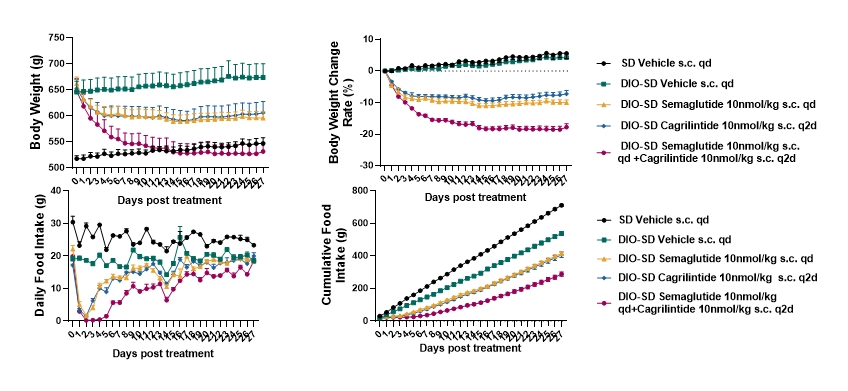
图6. 集萃药康项目数据显示,Cagrilintide(Amylin类药物)不管单用还是与Semaglutide(司美格鲁肽)联用都有对DIO大鼠有显著的减重效果,与Semaglutide联用减重效果最为显著
参考文献
[1] Int J Mol Sci. 2024 Jan 26;25(3):1517.
[2] Physiological reviews vol. 91,3 (2011): 795-826.
[3] Proc Natl Acad Sci U S A . 2008 May 20;105(20):7257-62.
[4] Lancet (London, England) vol. 397,10286 (2021): 1736-1748.
[5] Front Endocrinol (Lausanne). 2021 Jan 8:11:617400.
[6] bioRxiv : the preprint server for biology 2025.01.13.632726. 15 Jan. 2025

