Nature子刊丨九州大学Minako Ito团队借助小鼠模型揭示哮喘病遗传机制
哮喘作为一种全球性健康问题,影响着2.6亿人的呼吸系统健康,我国哮喘总人数已超6000万。研究表明,孕期患有哮喘的母亲,其子代罹患哮喘的风险显著增加。尽管已有研究提示这种风险可能与胎儿期免疫系统的编程有关,但其具体分子体机制尚不明确。近日,九州大学Minako Ito团队在Nature Communications发表了题为“Maternal asthma imprints fetal lung ILC2s via glucocorticoid signaling leading to worsened allergic airway inflammation in murine adult offspring”的研究论文。该研究借助小鼠模型首次揭示了母体哮喘通过糖皮质激素信号通路影响胎肺II型固有淋巴细胞(ILC2)的功能状态,从而导致子代成年过敏性气道炎症加剧的全新机制。
ILC2作为一类不依赖抗原识别的固有免疫细胞,通过分泌IL-5、IL-13等促炎细胞因子驱动II型炎症,在哮喘的发病中扮演关键角色。研究不仅阐述了ILC2从胎儿到成年的“免疫记忆”传承现象,更为深入理解孕期环境因素与子代哮喘风险之间的关联提供了关键科学依据。
一、研究结果
母体哮喘加剧子代成年过敏性气道炎症
研究团队通过构建卵清蛋白(OVA)诱导受孕小鼠的哮喘模型,观察到其子代成年后在接触尘螨抗原(HDM)时,肺组织嗜酸性粒细胞、ILC2数量较对照组(未经过OVA刺激母体的后代)显著增多,气道高反应性和炎症评分均显著高于对照组。更关键的是,该效应与母子间抗原特异性无关联——即便母体与子代接触不同过敏原(OVA与HDM),子代中炎症加剧的现象仍持续存在,这表明存在“抗原非依赖”的隔代传递机制。
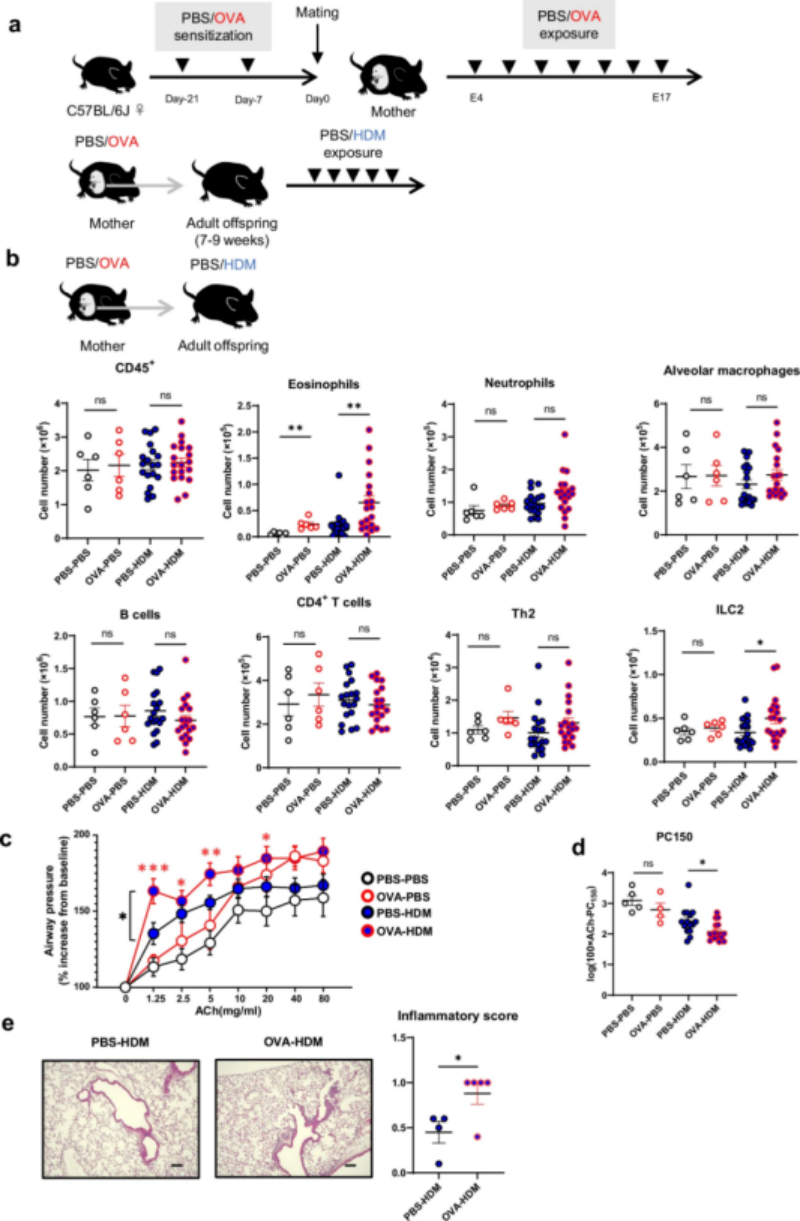
图1 母体哮喘以抗原非特异性方式加剧后代肺部炎症
成年子代肺ILC2自主功能亢进是其炎症加剧的核心因素
研究人员借助流式细胞术检测发现,受孕哮喘小鼠模型子代中肺ILC2中,IL-5+、IL-13+细胞比例显著高于对照组。体外培养实验显示,在IL-33刺激下,这些子代 ILC2分泌IL-5和IL-13的水平显著升高。通过过继转移实验进一步证实,将受孕哮喘小鼠模型子代的ILC2移植至ILC2缺陷小鼠后,受体小鼠肺内嗜酸性粒细胞浸润程度及ILC2活化水平均显著高于对照组。上述结果表明,ILC2本身功能亢进是驱动炎症加剧的核心因素,而非由局部微环境变化主导。
研究人员进一步在孕期对受孕哮喘小鼠模型注射抗IL-7Rα抗体,以清除胎鼠ILC2。结果显示,子代成年后,其肺内嗜酸性粒细胞数量、ILC2数量及细胞因子分泌水平均显著降低。该实验直接证实,胚胎期ILC2的异常编程是导致成年期炎症加剧的必要条件,提示胚胎期可能是阻断该病理进程的关键干预阶段。
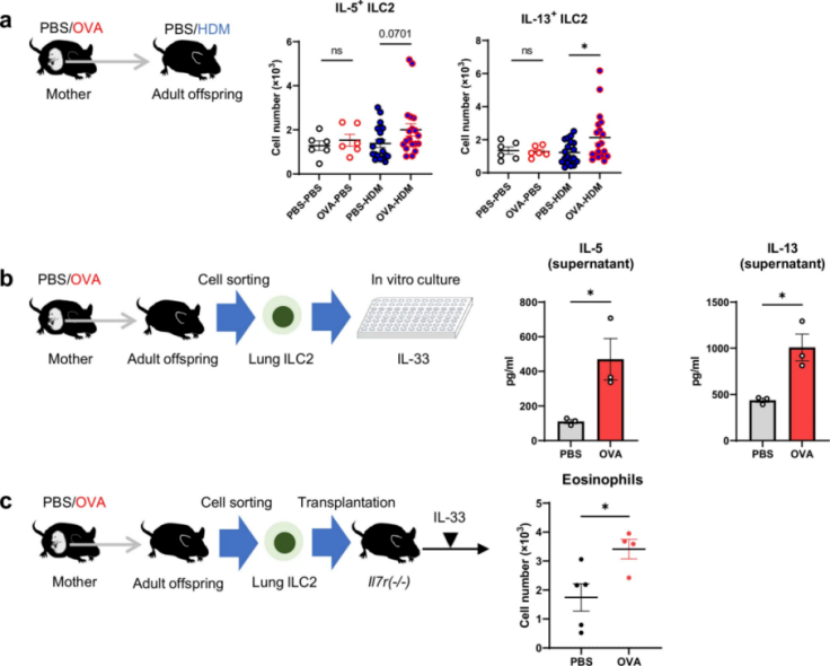
图2 母体哮喘增强成年后代肺部2型固有淋巴细胞(ILC2s)
胎肺ILC2的基因表达与表观遗传重塑
研究人员对妊娠18天的胎肺组织进行分析,发现胎肺中ILC2已呈现活化状态,关键基因如IL-1受体相关蛋白(Il1rl1)、转录因子Gata3及糖皮质激素受体(Nr3c1)表达水平显著上调。单细胞RNA测序结果显示,通过亚群分析发现一类高表达Nr3c1的ILC2亚群比例显著增加,这一现象提示胎儿时期ILC2已发生预先编程。
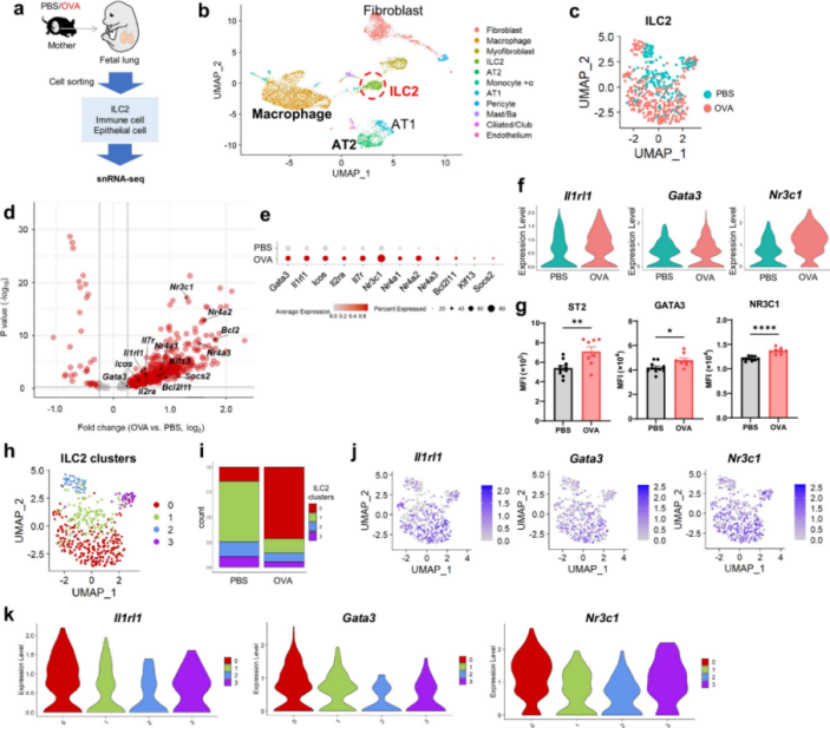
图3 与对照组相比,母体哮喘模型中后代胎肺ILC2s表现出不同的基因表达
研究人员进一步利用单细胞染色质转座酶可及性高通量测序(scATAC-seq)技术发现,胎儿时期和成年子代肺ILC2中存在共同的染色质开放区域,这些区域涉及MAPK信号通路和糖皮质激素受体Nr3c1结合位点。该结果表明,母体哮喘诱导的表观遗传改变可从胎儿时期持续至成年阶段,形成长期的表观遗传“记忆”。
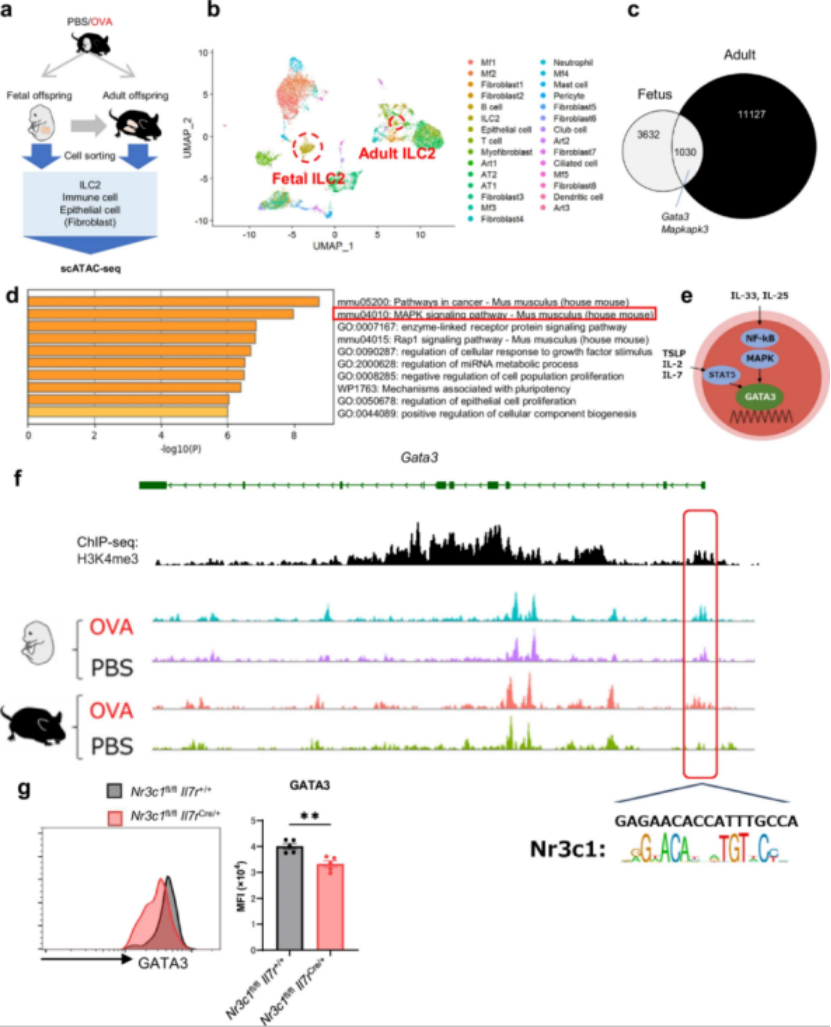
图4 母体哮喘模型中后代肺部ILC2s的表观遗传变化从胚胎期到成年期存在重叠
孕期糖皮质激素暴露模拟受孕哮喘小鼠模型对子代ILC2的影响
研究人员检测受孕哮喘小鼠胎鼠的羊水和血清,发现其中皮质酮(糖皮质激素)浓度显著升高。为探究糖皮质激素的作用机制,研究团队通过孕期给予地塞米松(DEX)模拟高糖皮质激素环境。实验结果显示,该处理组胎肺ILC2中Gata3、Nr3c1的表达水平,以成年期ILC2活化表型,均与受孕哮喘小鼠模型高度一致; 此外,接受DEX处理的子代成年后,在接触HDM时引发的气道炎症和ILC2功能亢进现象同样显著加剧。上述发现表明,母体哮喘状态下升高的糖皮质激素是驱动胎儿ILC2编程的关键因素,且该激素与哮喘病理过程存在协同作用。
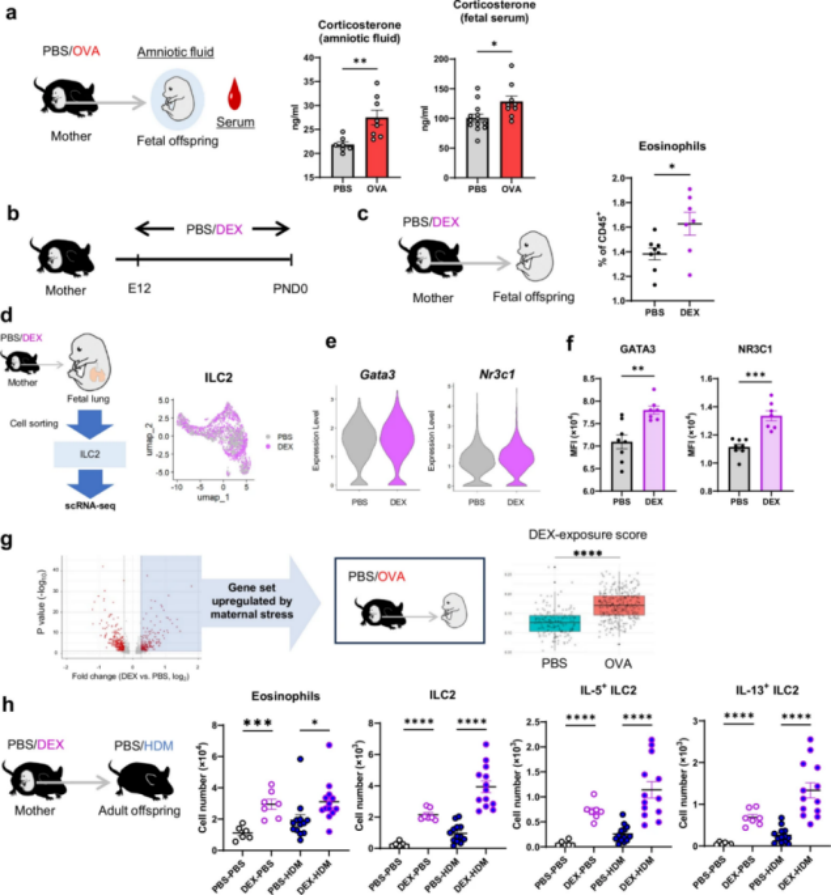
图5 糖皮质激素信号传导参与哮喘易感性从母体到后代之间的传递
二、结论
本研究通过小鼠模型首次系统阐明,母体哮喘可通过糖皮质激素信号通路重塑胎儿肺ILC2的基因表达谱与表观遗传状态。这种免疫“印记”效应会持续至子代成年阶段,导致ILC2对过敏原刺激的反应性显著增高,最终加剧过敏性气道炎症。研究不仅揭示了胎儿时期免疫编程在哮喘跨代传递中的核心作用,更通过机制解析为早期干预提供了新靶点——靶向ILC2的糖皮质激素信号或表观遗传调控,有望成为阻断孕期自免炎症风险向子代传递的潜在策略。

