武汉大学周严教授团队揭示KDM2B通过转录沉默神经祖细胞中的Wnt信号调节海马形态发生
海马作为大脑重要的结构之一,其在学习、空间记忆及情绪调节等方面都发挥极其重要的作用。哺乳动物大脑的海马包括三个主要的区室:海马固有区,可分为三个锥体亚区[cornu ammonis(CA)]、齿状回(DG)和海马下托(subiculum)。在胚胎和出生后早期阶段,各种不同类型的细胞需要精确地产生、迁移和组装以产生一个功能性海马。其中,DG的形成依赖于不同位置相继出现的生发灶,这些生发灶在DG的不同部位产生颗粒细胞。发育过程中的细胞特化需要转录因子(TFs)、表观遗传因子和顺式作用元件的协同作用,以确保精确的基因表达和沉默。发挥胚胎发生、器官发生和组织稳态调控作用的一个关键调控因子是抑制性组蛋白修饰,它包括H2AK119ub1,H3K27me3等,由PRC1和PRC2修饰。KDM2B包含两个主要的异构体,且都具有CxxC锌指(ZF)结构域,CxxC ZF是发挥将PRC1募集到非甲基化CpG岛(CGIs)作用的关键成分。

2023年10月,武汉大学周严教授课题组在Nature Communications(IF=16)发表了题为“KDM2B regulates hippocampal morphogenesis by transcriptionally silencing Wnt signaling in neural progenitors”的研究论文。该研究采用Kdm2bfl/fl,Emx1-Creand Nestin-Cre以及集萃药康来源的B6/JGpt-Rnf2fl/fl/Gpt小鼠,进行了表型分析,行为学实验,RNA-seq和ChIP-seq分析等,揭示了KDM2B在海马形态发生中的关键作用,并阐明了其通过转录沉默Wnt信号通路来调控神经前体细胞的机制。这一研究为深入理解海马发育和神经系统功能提供了重要的启示。
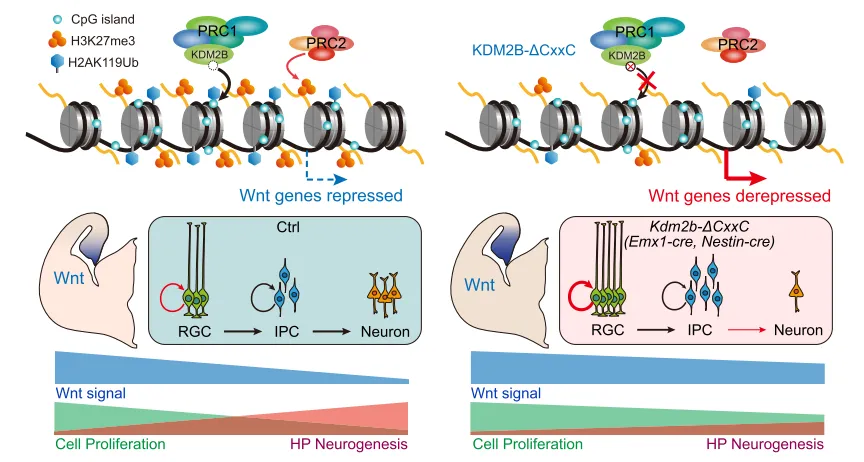
1.敲除KDM2B-CxxC导致海马发育不全
首先,作者靶向编码KDM2B-CxxC锌指结构域的75个氨基酸的外显子13,制作了Kdm2bflox(CxxC)小鼠,并分别与Emx1-Creand Nestin-Cre小鼠杂交,产生Kdm2bEmx1-ΔCxxC and Kdm2bNestin-ΔCxxC两种条件性敲除小鼠模型(cKO)以去除KDM2B在发育中的背端脑祖细胞中染色质关联能力。Kdm2bNestin-ΔCxxC在P7天前死亡,而Kdm2bEmx1-ΔCxxC小鼠与野生相比生存情况无明显异常。经过进一步分析,结果显示cKO成年小鼠的脑部海马显著变小、调节突触可塑性和记忆的Calbindin表达细胞、NeuN+颗粒细胞、GFAP+SOX2+神经干细胞(NSCs)等显著减少。部分细胞结构紊乱,不规则和异位分散等。结果表明,KDM2B在发育的前脑背侧染色质关联能力的消融导致海马发育不全,而成年cKO新皮质的变薄可能继发于脑室扩张。
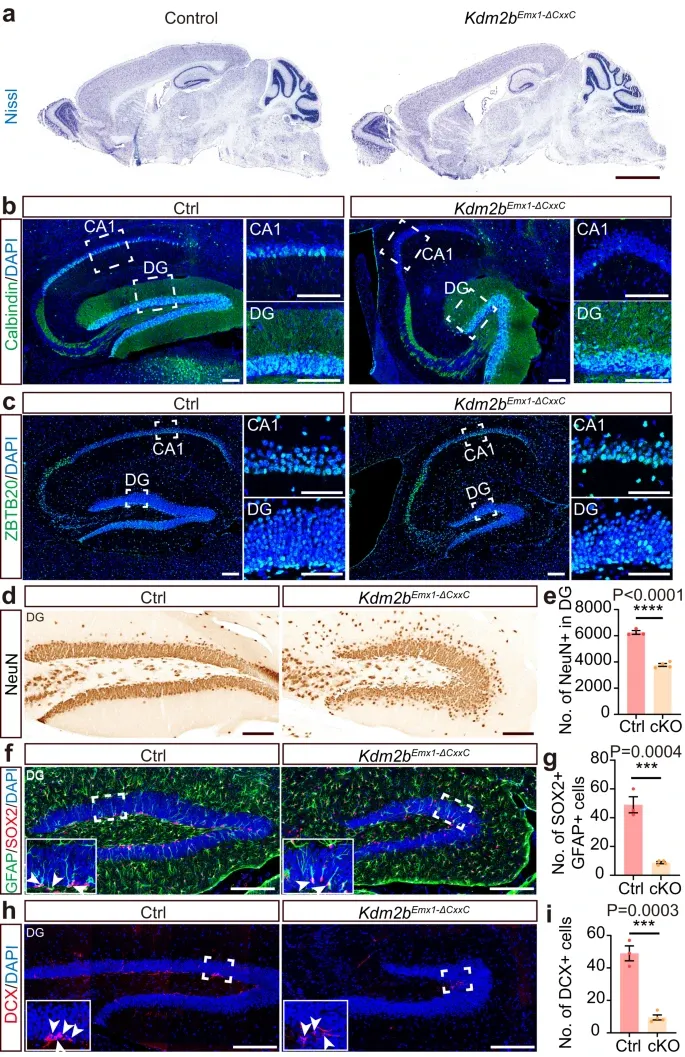
图1.KDM2B-CxxC的缺失导致海马发育不全
2、Kdm2bΔCxxC小鼠表现出记忆和学习缺陷
由于海马对学习、空间导航、记忆巩固以及探索等行为极其重要,因此,作者进行了一系列行为测试。水迷宫实验显示cKO小鼠存在空间学习缺陷,环境声诱导恐惧条件反射测试中cKO小鼠的僵直时间均为延长。旋转棒性能测试表明,cKO小鼠的运动协调和学习能力受损。矿场试验显示cKO小鼠不愿探索开阔场地的中心区域。一系列行为学实验表明,KDM2B染色质关联能力的减弱导致海马发育失败,这可能导致记忆和学习缺陷。
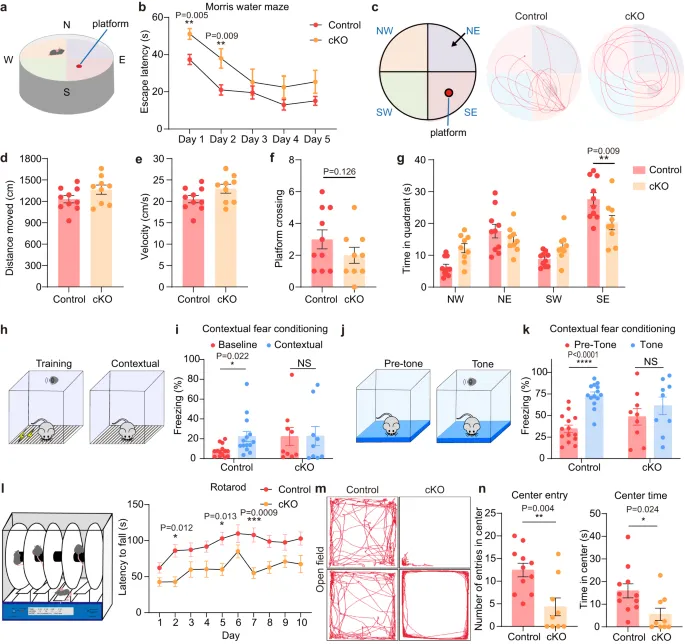
图2.Kdm2bEmx1-ΔCxxC小鼠在空间记忆、情境恐惧条件反射和运动学习方面表现出缺陷
3、KDM2B-CxxC缺失阻碍神经发生和迁移
为了探究KDM2B-CxxC缺少对DG神经的影响,作者进一步通过EdU标记细胞的分布并统计了表达特定神经标记物的细胞数量,观察了中间祖细胞和神经元沿迁移路径的分布,排除了星形细胞支架缺陷导致的中间祖细胞(IPCs)迁移缺陷的可能性。Kdm2bNestin-ΔCxxC小鼠的观察结果与Kdm2bEmx1-ΔCxxC小鼠的观察结果几乎相同,即TBR2+IPCs在DNe和DMS显著积累,但在DG中数量减少。这表明,KDM2B-CxxC的缺失导致的IPCs迁移缺陷不是由于皮质下缘(CH)来源的星形细胞支架的缺陷引起的。因此,KDM2B-CxxC的缺失阻碍了IPCs的迁移,进而影响了颗粒神经元的产生和定位,从而影响了海马形成过程。
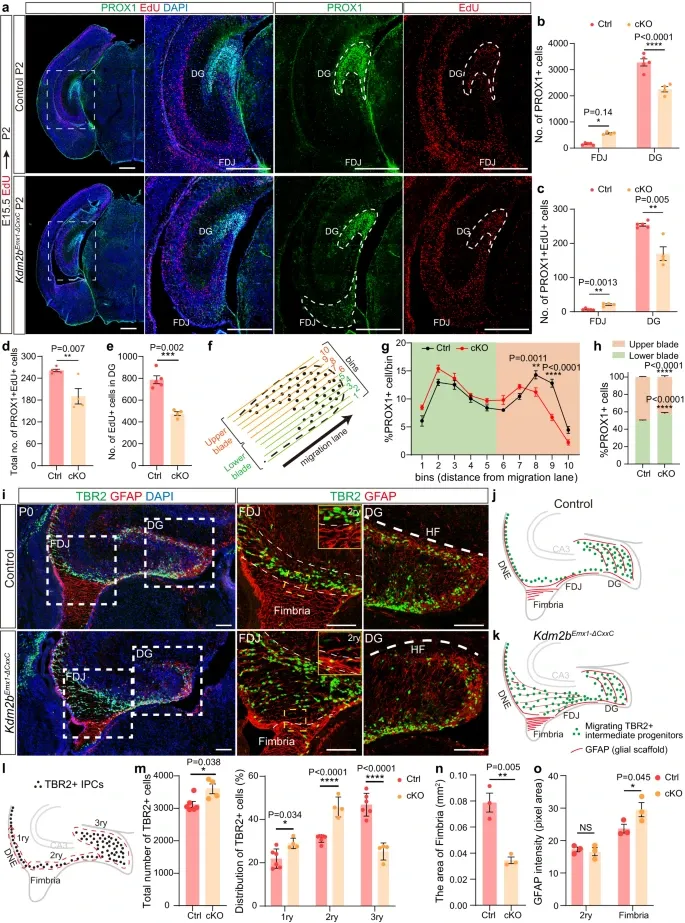
图3.KDM2B-CxxC缺失时神经祖细胞分化受阻
4、KDM2B -ΔCxxC异常激活HP中的Wnt信号
为了进一步探究KDM2B缺失导致海马发育不全的分子机制,作者收集了P0对照和Kdm2bEmx1-ΔCxxC小鼠大脑的海马组织并进行RNA-seq转录组分析,结果显示cKO小鼠的海马中有886个基因被激活,575个基因被抑制。其中发现,cKO海马中Pax6、Neurog2和TBR2/Eomes等祖细胞标志物的表达水平升高。GO分析显示,上调的基因包括了与形态发生、典型Wnt信号通路等相关基因,而下调的基因包括了与神经元结构和功能相关的基因。为了进一步验证cKO小鼠海马中典型的Wnt信号增强,作者将CKO小鼠与BAT-GAL [B6.Cg-Tg(BAT-lacZ)3Picc/J] Wnt报告小鼠杂交。β -半乳糖苷酶染色显示P0 cKO海马具有较强的典型Wnt活性,包括CA区和FDJ区。典型Wnt信号基因如Lef1和Sfrp2的成分升高。表明了KDM2B -ΔCxxC异常激活HP中的Wnt信号。
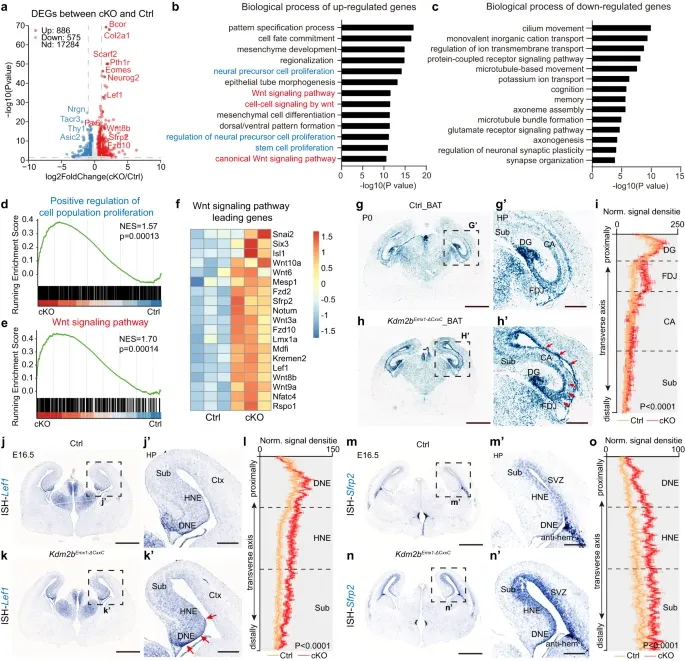
图4.KDM2B-CxxC的缺失导致海马Wnt信号通路的激活
5、KDM2B在海马发育过程中抑制Wnt信号通路基因的组成部分
KDM2B是PRC1变体的关键组成部分,介导抑制组蛋白修饰。为了探究KDM2B-CxxC的缺失如何影响海马组织的修饰,以及与增强的Wnt信号通路的关系。作者使用ChIP-seq实验,结果显示,cKO海马组织和神经球中H2AK119ub和H3K27me3的总体水平下降。RT-qPCR结果显示,cKO海马中的多个Wnt配体以及Sfrp2均显著升高。
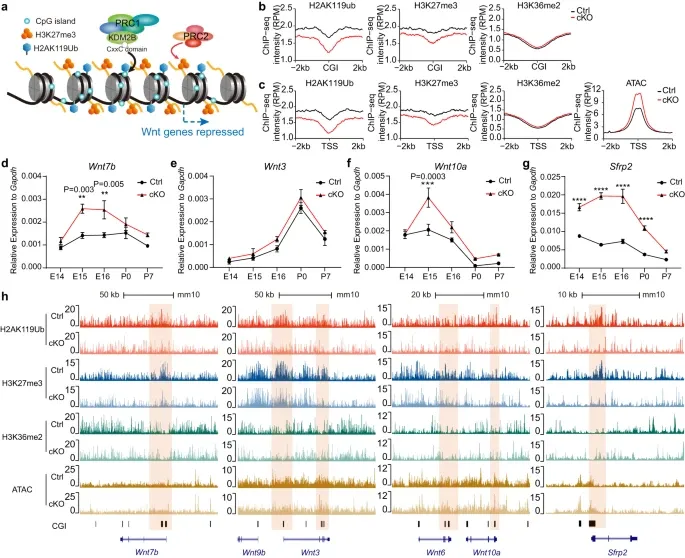
图5.KDM2B在海马发育过程中抑制Wnt信号通路基因的组成部分
6、Ring1B缺失不引起祖细胞积累
KDM2B将PRC1.1的其他组成部分,包括泛素蛋白连接酶Ring1B(编码基因为Rnf2),招募到CGIs来启动和稳定基因沉默。为了探究PRC1的功能失调是否导致了Kdm2b cko海马神经祖细胞的迁移和分化障碍。作者将Rnf2-flox小鼠与Emx1-Cre小鼠杂交,获得了Rnf2Emx1-cKO小鼠。进一步分析发现,Rnf2Emx1-cKO小鼠P0天H2AK119ub、H3K27me3的水平均有所下降,海马区比对照组小,海马中TBR2+祖细胞数量以及在DGs中的分布明显减少。然而,海马的FDJ区没有TBR2+IPCs的聚集和分散。因此,虽然PRC1的功能丧失也会导致海马发育不全,但并不会导致海马发育的迁移路径中神经祖细胞的形成。尽管Wnt通路和神经发生基因在Kdm2bEmx1-ΔCxxC海马中上调,但在Rnf2Emx1-cKO海马组织中,它们没有显著改变。表明了,KDM2B-CxxC的缺失减少了关键Wnt信号基因的抑制性组蛋白修饰,从而导致Wnt激活延长,从而阻碍海马祖细胞的分化和迁移。
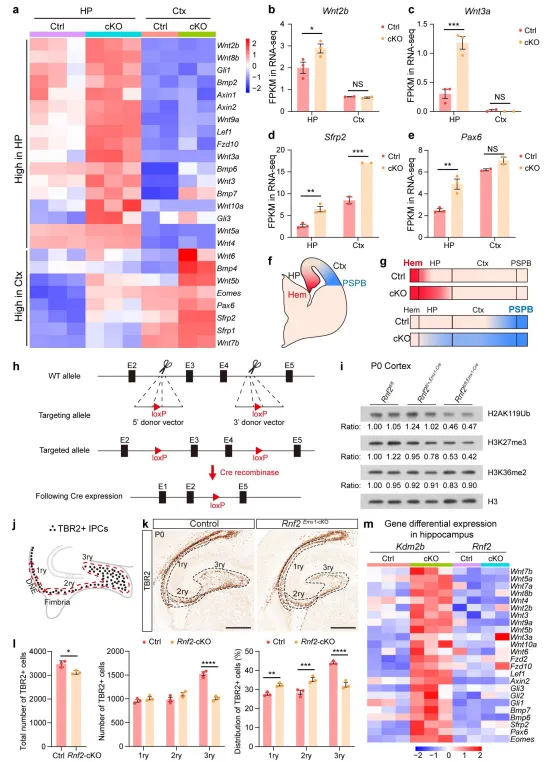
图6.Ring1B缺失不引起祖细胞积累
结论
这篇论文主要研究了KDM2B在调节海马体形态发生中的作用。KDM2B-CxxC的缺失导致抑制性组蛋白修饰减少,Wnt信号通路被激活,从而阻碍海马体前体细胞的正常迁移和分化。

