南京大学姜晓宏团队揭示寒冷激活的棕色脂肪来源的细胞外囊泡-miR-378a-3p刺激雄性小鼠肝脏糖异生
在寒冷暴露期间,激活的棕色脂肪组织(BAT)消耗大量的循环葡萄糖来为非寒颤产热提供燃料,并防御体温过低。然而,在这种体温调节挑战下,我们对BAT控制葡萄糖稳态的内分泌功能知之甚少。
2023年8月,南京大学姜晓宏团队在NatureCommunications期刊(IF16.6)在线发表了一篇题为Cold-activated brown fat-derived extracellular vesicle-miR-378a-3p stimulates hepatic gluconeogenesis in male mice的研究论文。该研究采用集萃药康小鼠T012101 Mir378a-KO(C57BL/6JGpt-Mir378aem15Cd3796/Gpt)开展相关研究,报道了在雄性小鼠中,寒冷激活的BAT源性细胞外囊泡(BDEVs)通过在寒冷应激期间促进肝脏糖异生来重编程全身葡萄糖代谢。寒冷暴露刺激miR-378a-3p(BAT富集的miRNAs之一)选择性封装到EV中并递送到肝脏中,通过靶向p110α促进糖异生。证明了寒冷诱导的BDEV含有的miR-378a-3p可以作为一种内分泌信号分子来调节寒冷应激下的肝脏糖异生。

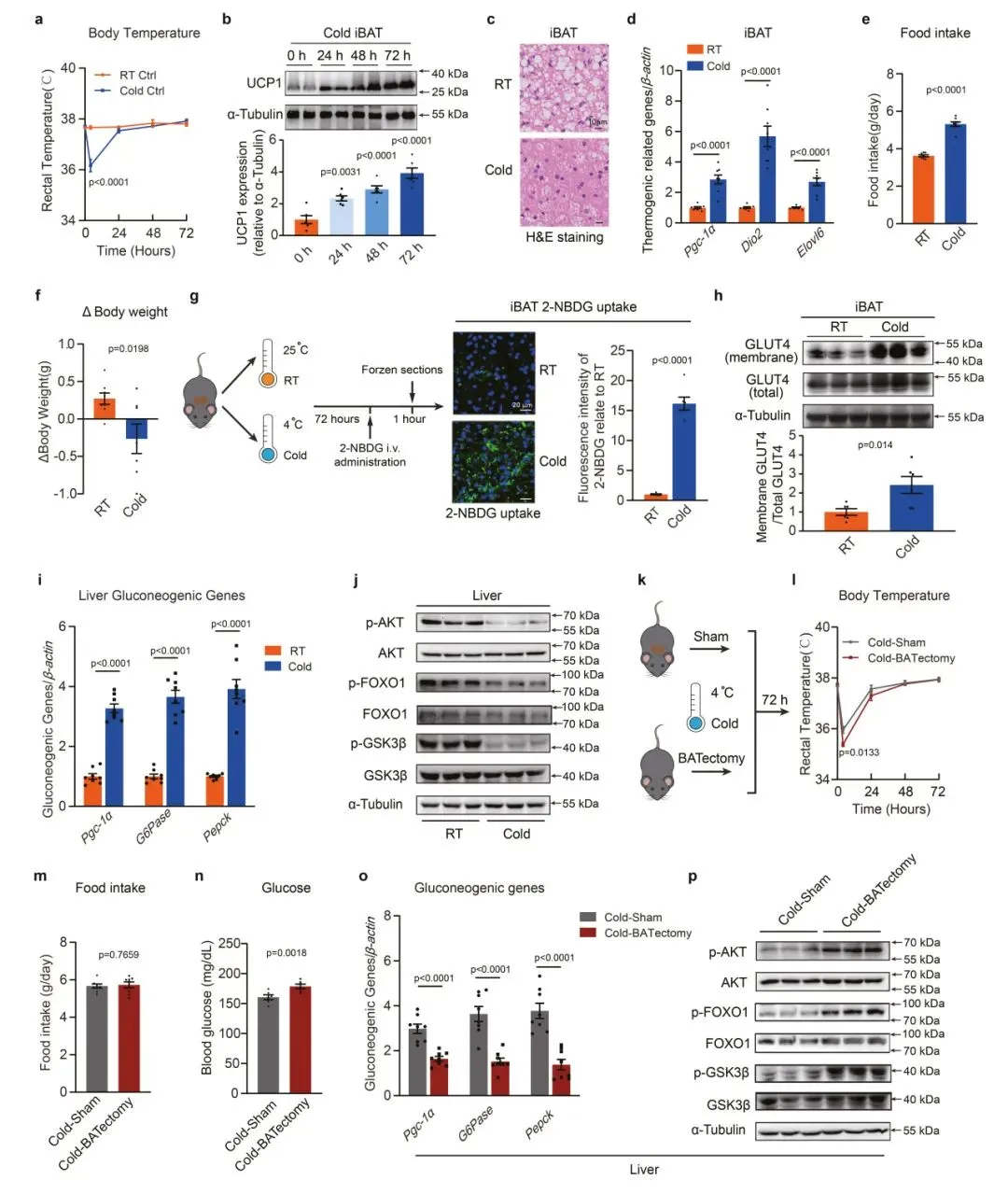
1、寒冷激活的BAT促进肝脏糖异生
研究发现,代谢率的提高可以抵御低温,寒冷暴露显著增加了BAT的葡萄糖摄取。有趣的是,低温暴露小鼠的肝脏糖异生也显著增加;研究发现BAT的激活可能通过促进寒冷应激下肝脏糖异生直接影响肝脏糖代谢。
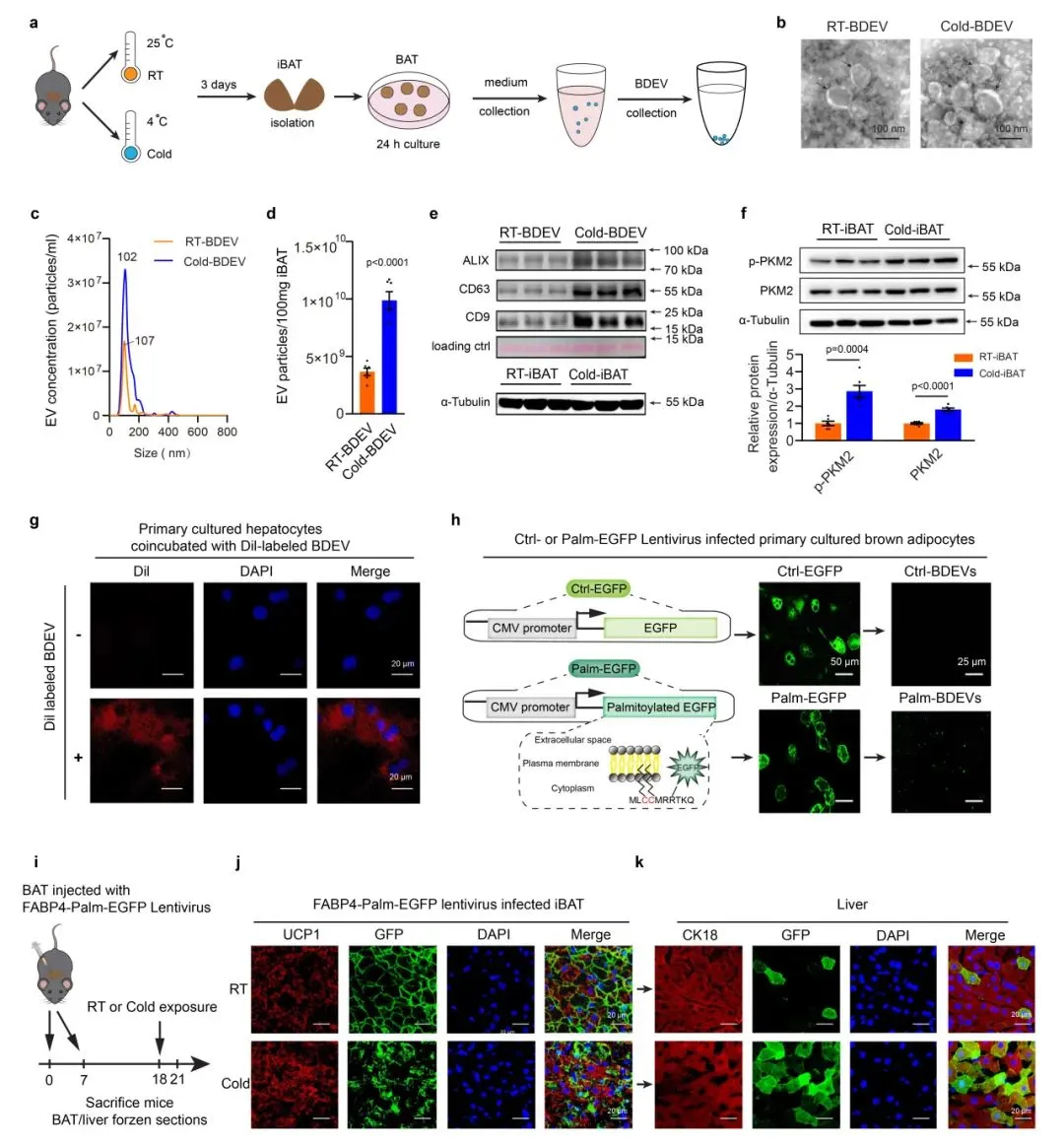
2、寒冷应激促进棕色脂肪组织(BAT)来源的细胞外囊泡分泌并递送到肝脏
研究发现,Cold-BAT普遍比RT-BAT分泌更多的EV,并且寒冷激活BDEVs中EV标记物(包括CD9、CD63和ALIX)的蛋白水平显著升高。此外,PKM2也可能在促进活化BAT释放EV中起关键作用。随后,研究证实了寒冷暴露促进了BDEV的分泌并递送到肝脏。
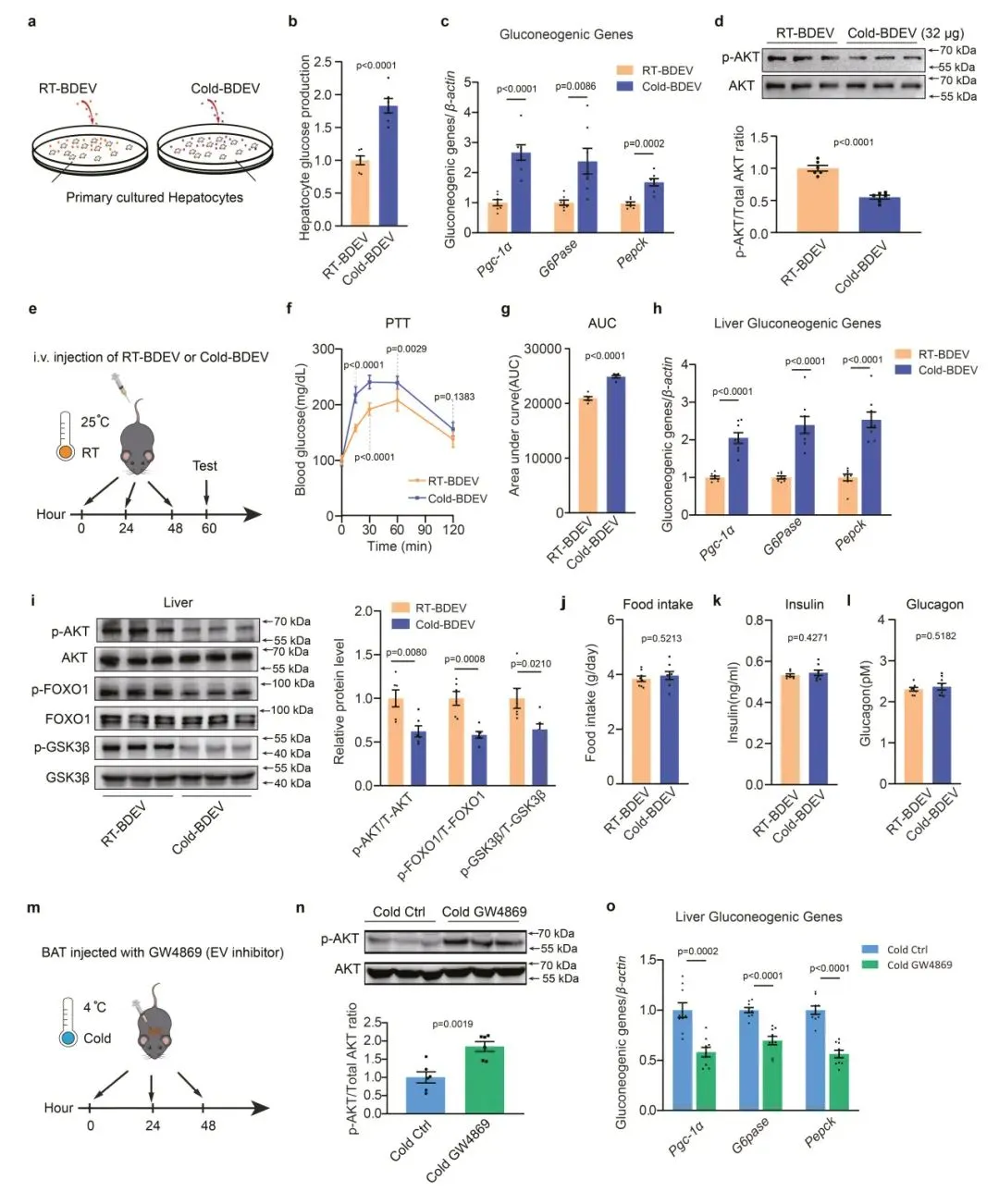
3、寒冷激活的BDEVs增强糖异生
为了验证Cold-BDEVs在调节糖异生方面的关键作用,研究人员还使用EV分泌抑制剂GW4869来阻断寒冷诱导的BDEV产生。结果显示,GW4869处理后,小鼠肝脏中磷酸化AKT增加,糖异生基因表达降低。这些结果证明了激活的BDEVs在寒冷暴露期间促进肝脏糖异生的关键作用。
4、寒冷暴露诱导BDEVs中miR-378a-3p的富集
研究人员进行了深度测序,结果发现,miR-378a-3p和miR-193b-3p是两个富集在肩胛间BAT(iBAT)中的miRNAs,在iBAT中的表达水平远高于包括肝脏在内的其他组织,并且它们的表达水平在冷暴露后显著升高。选择miR-378a-3p进行进一步研究,其在冷暴露小鼠肝脏中的表达水平明显升高。
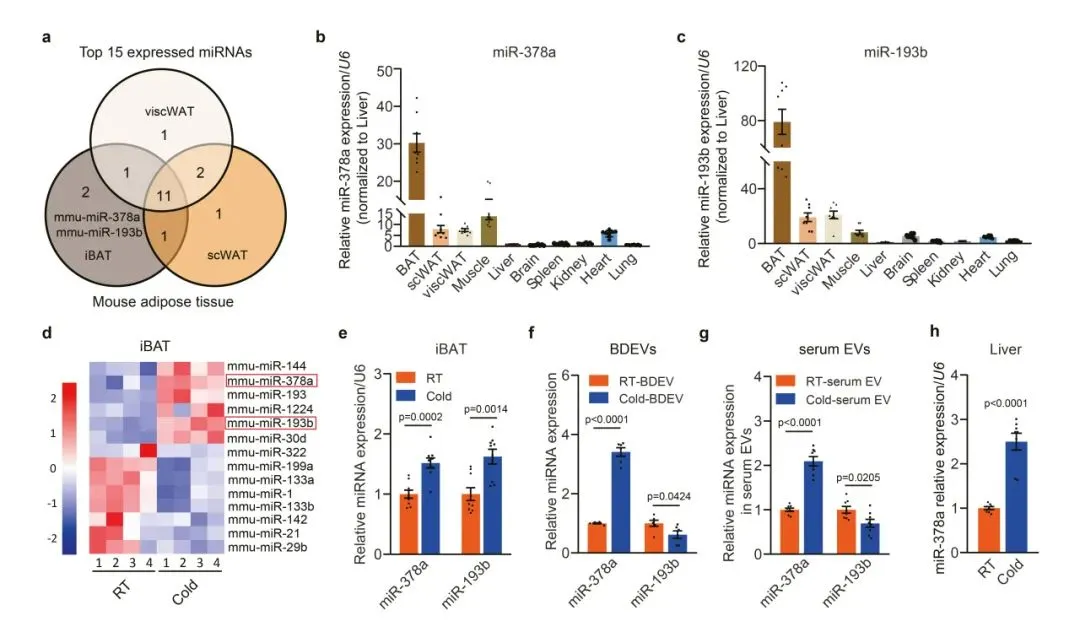
结果显示,寒冷暴露后,miR-378a(初级产物miR-378a)的转录水平在iBAT中显著升高,而在肝脏中没有升高。肝脏miR-378a-3p的上调可能不是来自肝脏从头合成,而是在寒冷暴露后将BDEV富集的miR-378a-3p递送到肝脏。
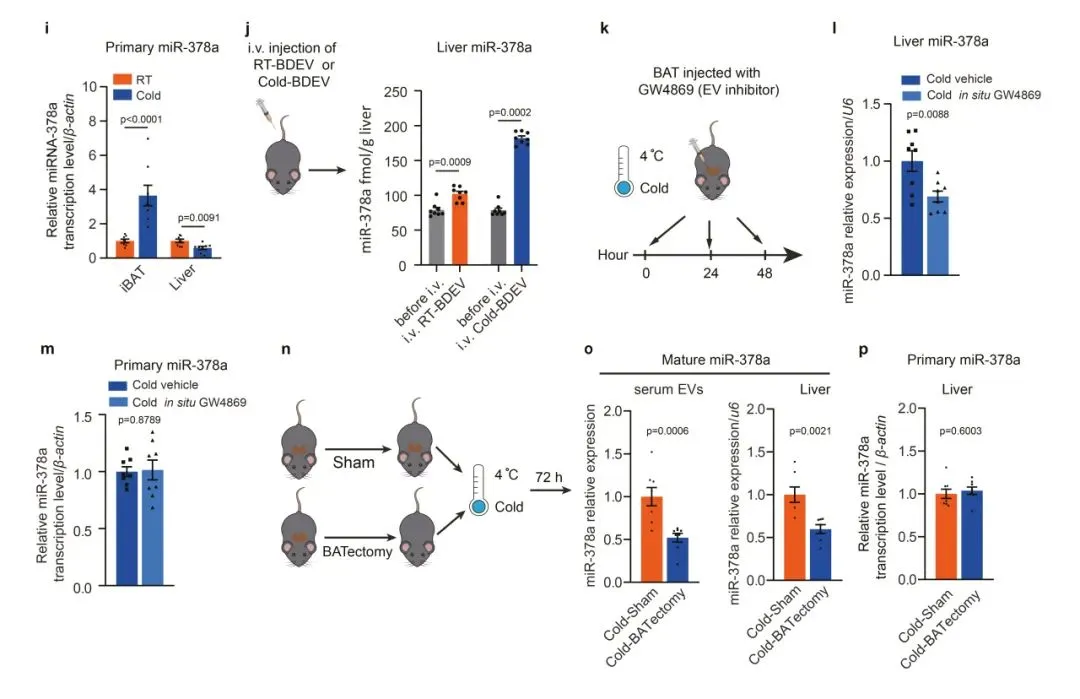
5、BDEV来源的miR-378a-3p促进糖异生
研究表明BDEV富集的miR-378a-3p可能是调节肝细胞糖异生的功能性信号分子;为了探索Cold-BDEV源性miR-378a-3p对肝细胞的影响,研究人员用不同剂量的anti-miR-378a转染原代肝细胞,并与Cold-BDEVs共孵育。结果发现,当anti-miR-378a剂量逐渐增加时,p110α蛋白水平也呈剂量依赖性升高,并在100 nM处理时达到最 大水平,此后保持不变。随着p110α蛋白水平的逐渐升高,糖异生基因的表达呈剂量依赖性下调,并在100 nM处理时降至最低水平。这些结果表明,miR-378a-3p在促进肝糖异生中起重要作用。
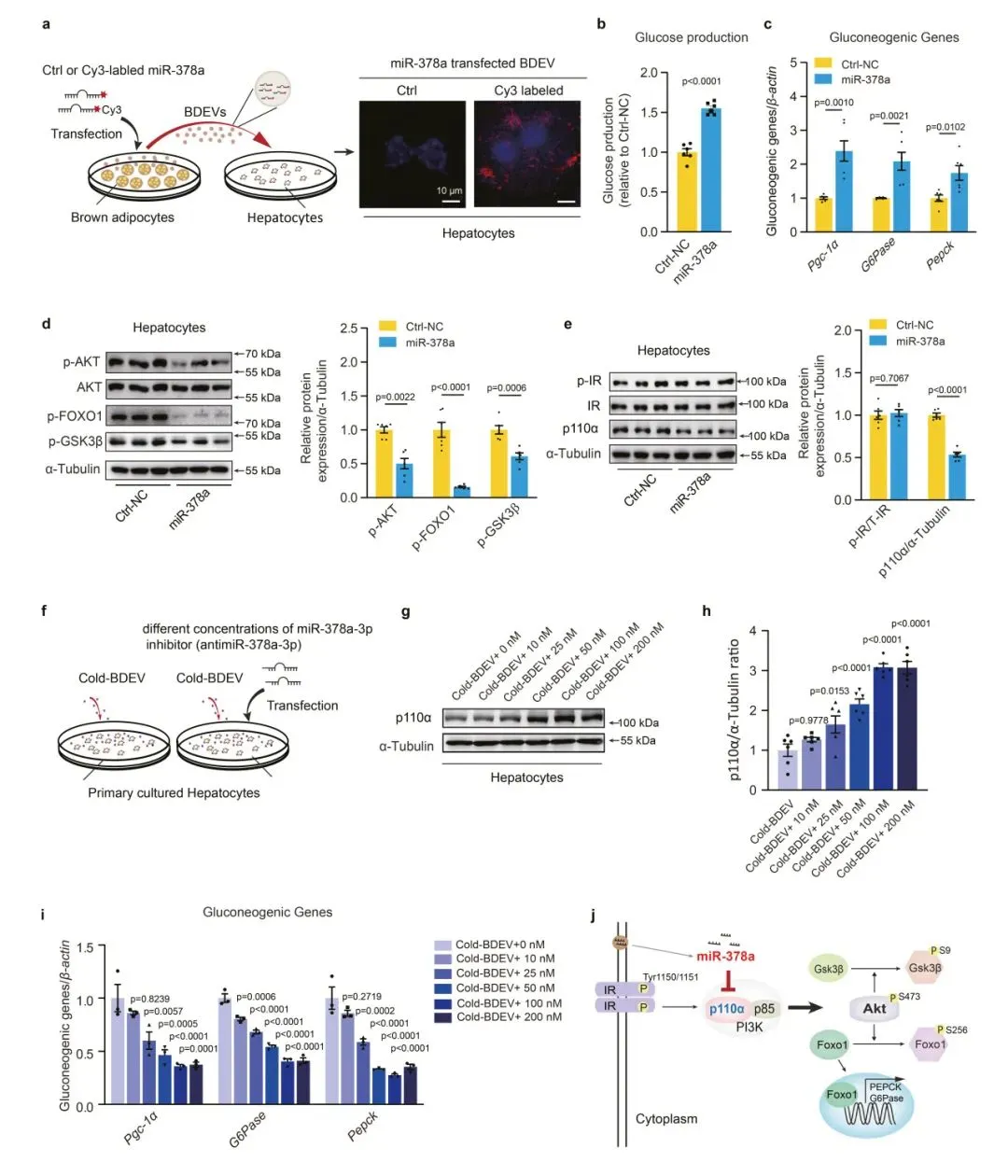
结果发现,iBAT中miR-378a-3p的过表达增加了miR-378a-3p分泌进入循环并递送至肝脏。将miR-378a-3p引入iBAT并没有改变iBAT或肝脏中内源性miR-378a-3p的转录水平。此外,该研究结果证实了miR-378a-3p通过靶向肝脏中的p110α直接影响IR下游因子。综上,BDEV含有的miR-378a-3p可以通过直接靶向肝脏p110α促进体内糖异生。
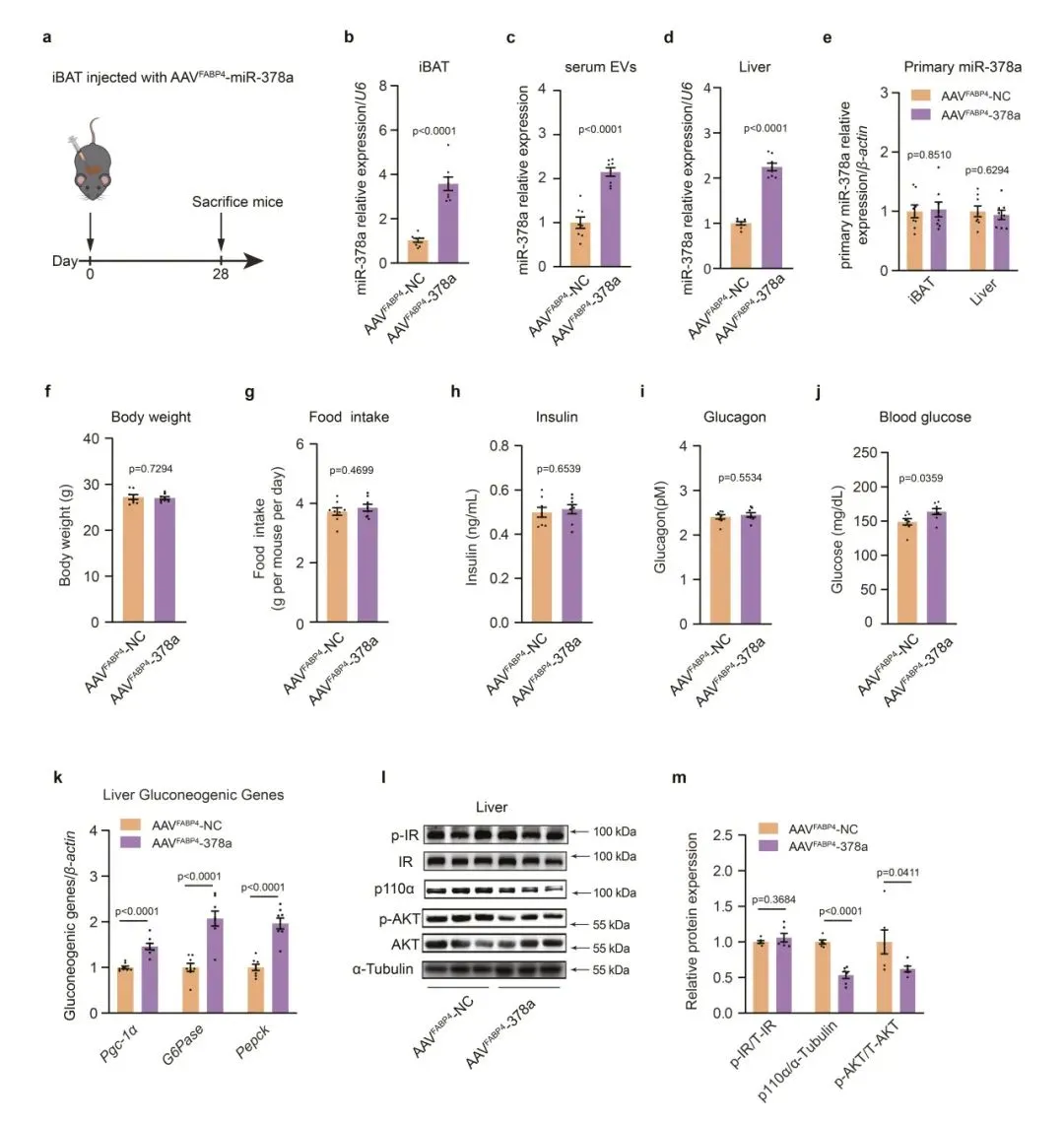
6、恢复iBAT中的miR-378a-3p挽救了miR-378 KO小鼠的肝脏糖异生
为了研究miR-378a-3p在寒冷暴露期间调节葡萄糖稳态中的作用,研究人员生成了MiR-378a KO小鼠模型(378KO)。结果发现,在RT饲养的Mir-378aKO小鼠肝脏中检测到p110α蛋白水平升高。Mir-378aKO小鼠的体重和食物摄入量没有明显变化,但血糖水平略有下降。此外,研究人员检查了寒冷暴露对Mir-378KO小鼠的影响。结果显示,与寒冷暴露WT对照相比,miR-378a的缺失表现出p110α的蛋白质水平显著增加。同样,在寒冷暴露的Mir-378KO小鼠的肝脏中,AKT磷酸化显著升高,Pgc-1α、G6Pase和Pepck表达降低,Mir-378KO小鼠的血糖水平降低,表明寒冷诱导的肝脏糖异生受损。此外,在iBAT中重新表达miR-378a-3p显著提高了Mir378a KO小鼠肝脏中的G6Pase和Pepck,进一步证实了BAT来源的miR-378a-3p直接促进肝脏糖异生。
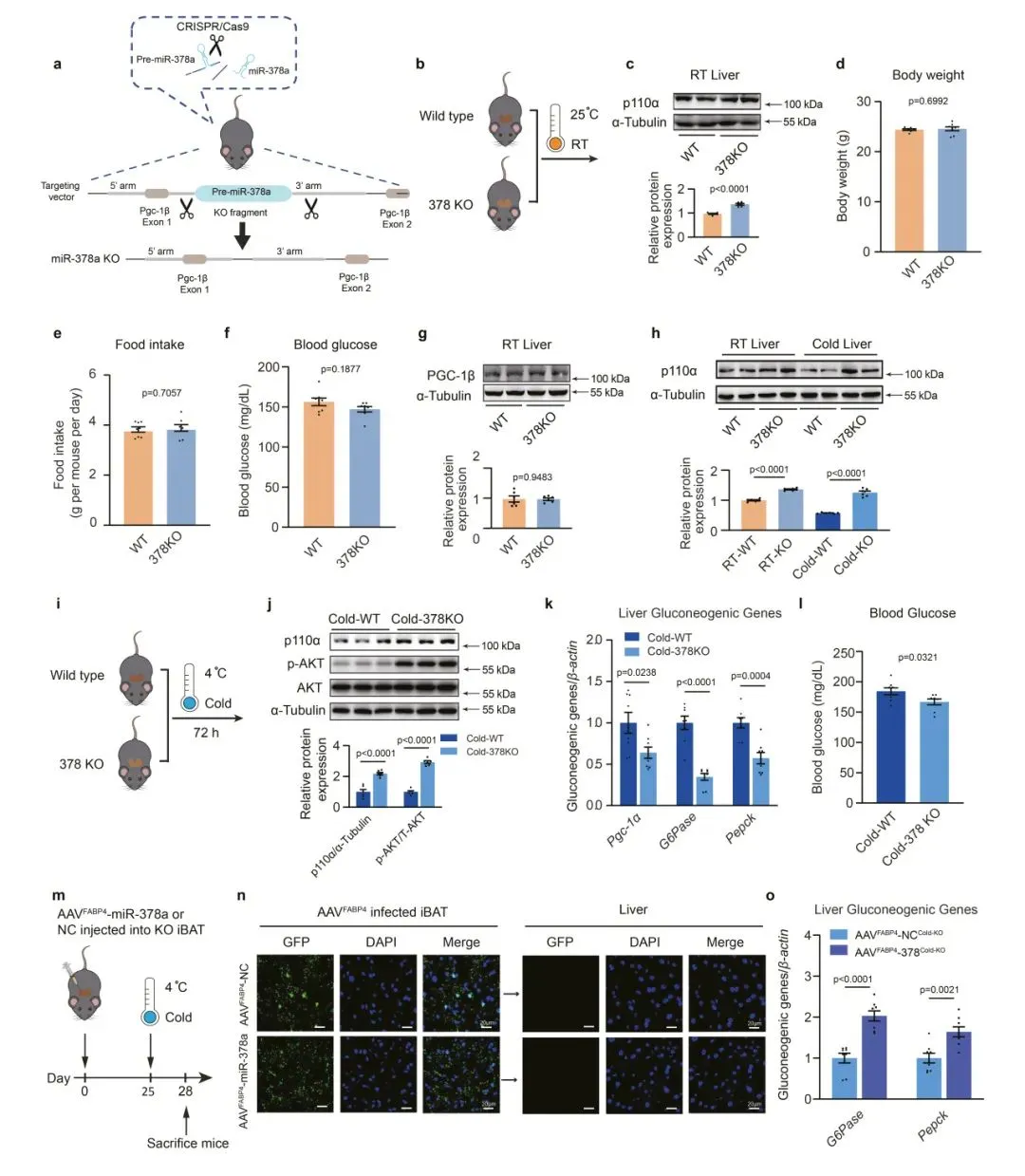
7、BAT中miR-378a的缺失损害了寒冷诱导的肝脏糖异生
为了特异性敲低肝脏中的miR-378a-3p,研究人员构建了AAVTBG-sponge,通过静脉注射到小鼠体内并置于RT。在感染后25天小鼠寒冷暴露处理72h,结果发现肝脏中miR-378a-3p的敲低导致p110α和p-AKT蛋白水平显著升高,同时G6Pase和Pepck、Pgc-1α的表达降低。证实了肝脏中miR-378a-3p的缺失会损害寒冷诱导的糖异生。与此同时抑制BAT中miR-378a可以抑制寒冷诱导的肝糖异生。
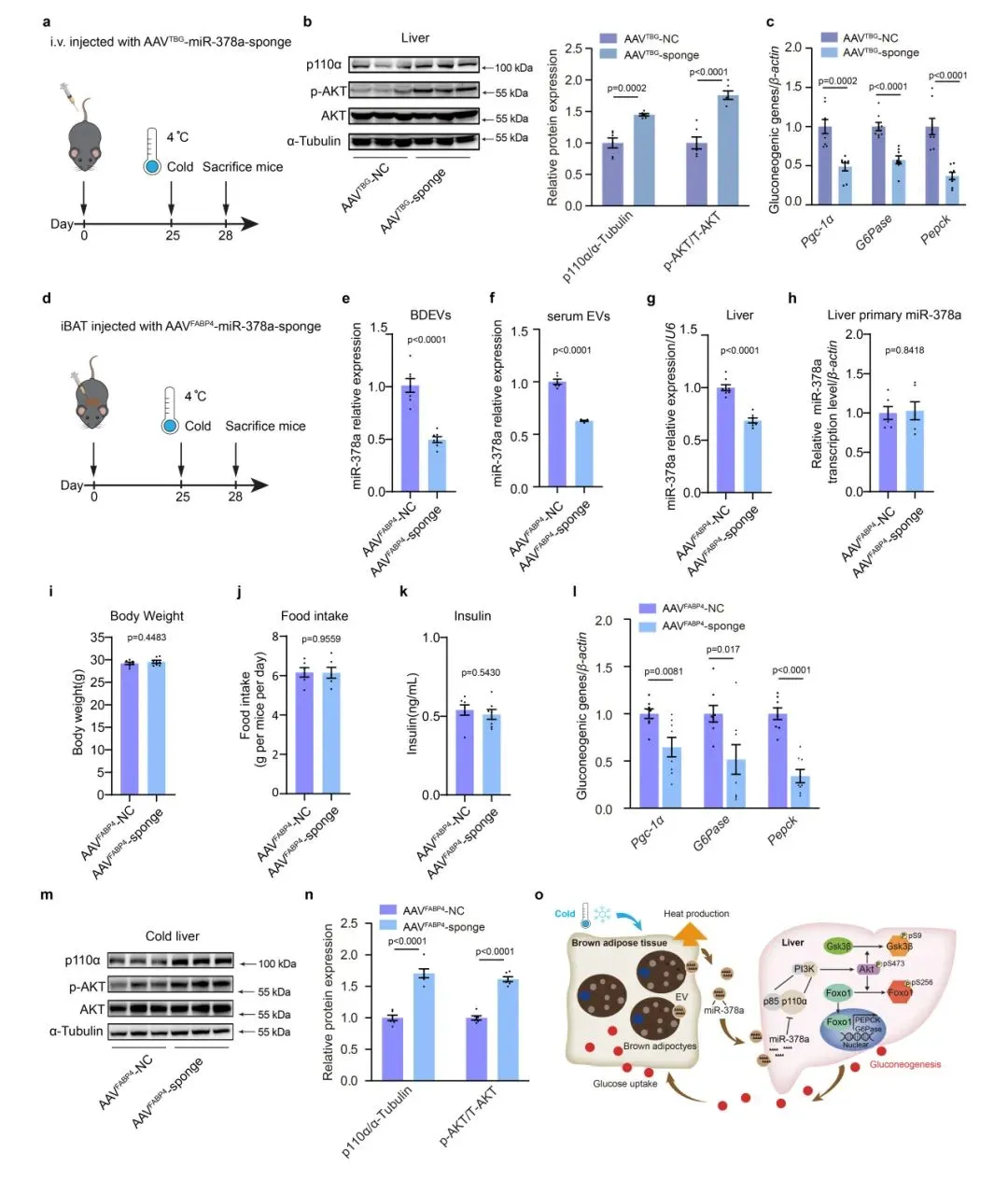
研究结论
总之,本研究表明,在雄性小鼠中,激活的BAT来源的细胞外囊泡(BDEVs)通过在寒冷应激期间促进肝脏糖异生来重编程全身葡萄糖代谢。寒冷暴露有助于将miR-378a-3p(一种BAT富集的miRNAs)选择性包装到EVs中并递送到肝脏。BAT来源的miR-378a-3p通过靶向p110α增强糖异生。miR-378 KO小鼠在寒冷暴露期间表现出肝脏糖异生减少,而iBAT中miR-378a-3p的恢复诱导肝脏中糖异生基因的表达。这些发现有助于我们理解BDEV-miRNA作为应激诱导的细胞因子来协调全身葡萄糖稳态的机制。这种miR-378a-3p介导的器官间通讯强调了BAT在预防寒冷应激期间低血糖方面的新型内分泌功能。

