突破PD-1治疗耐药:机制、策略与临床前突破
免疫检查点抑制剂(ICI),尤其是PD-1/PD-L1抗体,彻底改变了多种癌症的治疗格局。然而,原发性或获得性耐药仍是临床面临的主要挑战,约60-80%的患者无法从中持久获益。理解耐药机制并开发相应策略,是当今肿瘤免疫治疗的核心议题。
PD-1耐药机制与应对策略概览
PD-1耐药机制复杂多样,主要可归因于肿瘤细胞自身、肿瘤微环境(TME)及宿主全身性因素三大方面。下表概述了几类关键耐药机制及相应的解决策略。

PD-1耐药的临床前药效评价模型与新方案
针对上述复杂机制,我们成功建立了多种不同机制的PD-1耐药动物模型,并验证了克服耐药的治疗方案,为新药联合方案的开发提供了强有力的临床前评价数据支持。
1. TNG260:联手PD-1,攻克STK11突变壁垒
背景:STK11(LKB1)基因失活突变是非小细胞肺癌等癌症中对PD-1治疗无应答的关键标志物之一,其常导致免疫抑制性的肿瘤微环境。
策略与模型:TNG260是一种针对STK11突变肿瘤的新型免疫治疗药物,其作用机制主要通过抑制CoREST复合物,调节肿瘤免疫微环境,增强免疫细胞对肿瘤的识别和杀伤能力。我们构建了STK11敲除(KO)的同源小鼠肿瘤模型,并利用该模型评估了TNG260与抗PD-1抗体的联合疗法。
数据亮点:
单药PD-1无效:在STK11-KO模型中,单用PD-1抗体几乎无法抑制肿瘤生长(尤其是在BALB/c背景小鼠中,图1-1),模拟了临床耐药情况。
联合疗法显效:TNG260与PD-1联用后,表现出显著的协同抗肿瘤效果,肿瘤生长得到强力抑制,部分小鼠甚至达到肿瘤消退(尤其是在B6背景小鼠中,图1-2)。
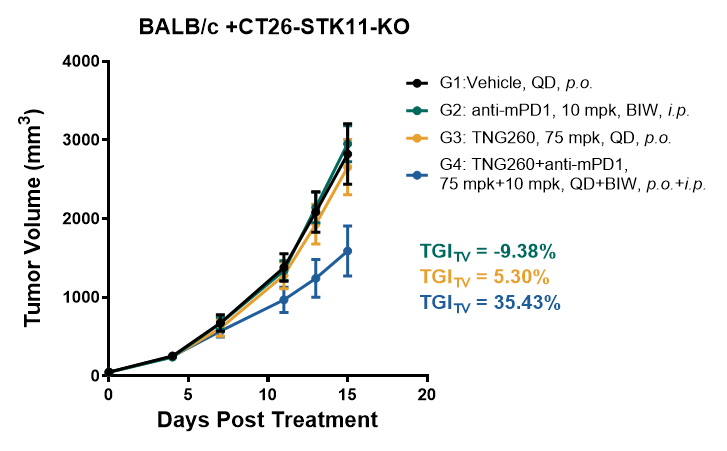
图1-1. BALB/c小鼠接种CT26-STK11-KO荷瘤模型中的药效学评价
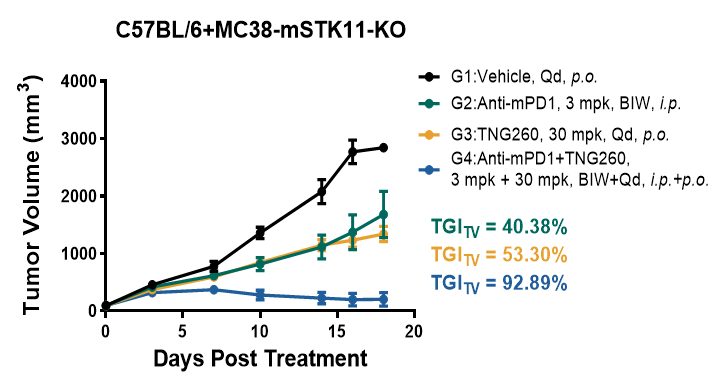
图1-2. C57BL/6小鼠接种MC38-STK11-KO荷瘤模型中的药效学评价
2. AK112:双重阻断,力压PD-1与VEGFi单打独斗
背景:VEGF/VEGFR通路不仅能促进血管生成,还直接参与介导免疫抑制。抗血管生成药物与PD-1联用已在临床取得成功,但开发更优效的双靶点药物是趋势所在。
策略与模型:AK112是一款首创的PD-1/VEGF双特异性抗体。我们在人源化PBMC免疫重建小鼠模型(该模型能更好地模拟人体免疫系统)中,对比了AK112与PD-1单抗、VEGFA单抗单独治疗的效果差异。
数据亮点:
协同效应最大化:AK112通过单个分子同时阻断PD-1和VEGF两条关键通路,在肿瘤局部产生了更强的协同效应(图2)。
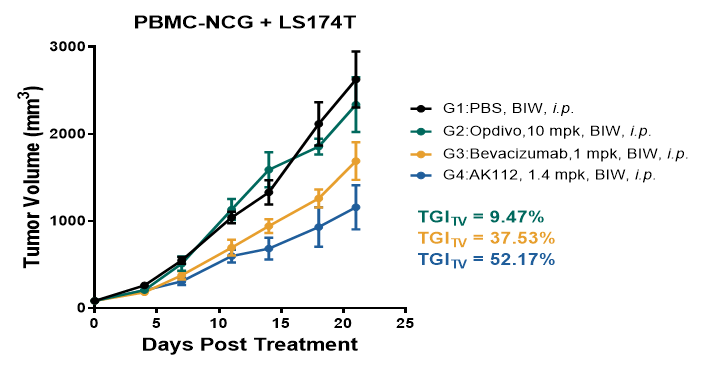
图2. PBMC-NCG人源化小鼠接种LS174T荷瘤模型中的药效学评价
3. PD1获得耐药:专为攻克PD-1耐药而生
背景:面对临床PD-1治疗普遍存在的耐药难题,我们成功构建了一款经过长期PD-1抗体药物诱导、具备稳定耐药特征的CT26肿瘤细胞株(图3-1),且耐药特征已经动物体内实验证实(图3-2)。
模型价值:这是一款为“筛选”而生的利器。它的核心价值在于为后续开发能够逆转PD-1耐药的新药,提供一个高度可靠、可预测的临床前评价工具。
数据亮点:流式分析(图3-3)及二代测序分析揭示了其清晰的耐药机制——肿瘤微环境中,具有杀伤功能的T细胞、NK细胞等显著减少,而抑制性的免疫细胞群体则异常增多。
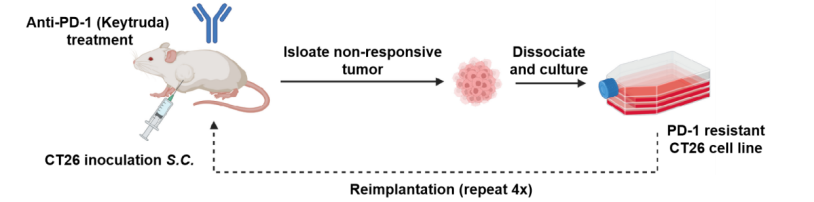
图3-1. 获得性PD1耐药模型的构建策略
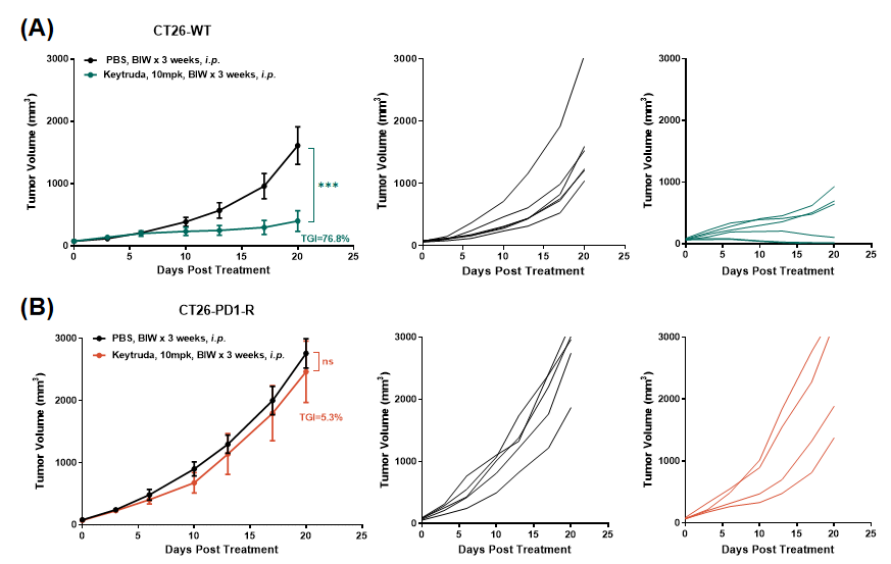
图3-2. PD1抗体药物在BALB/c-hPD1人源化小鼠分别接种CT26-WT原始细胞株或CT26-PD1-R耐药细胞株荷瘤模型中的药效学评价
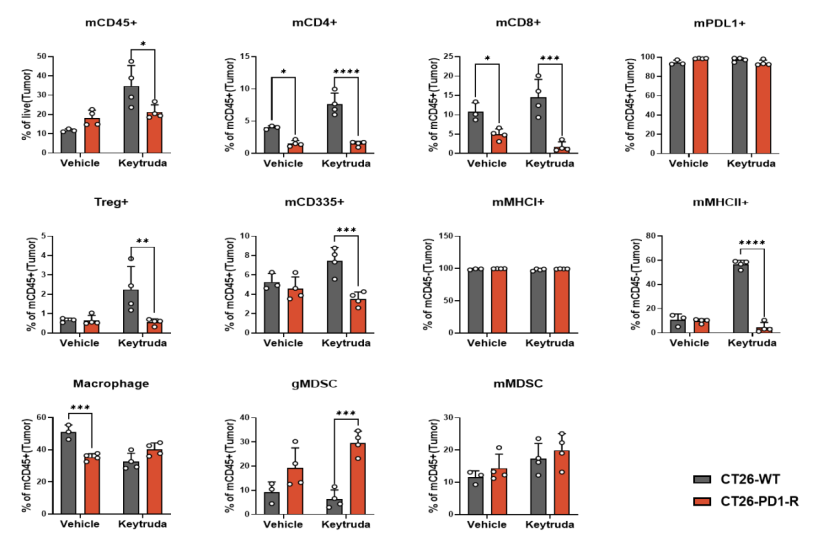
图3-3. 肿瘤中浸润的免疫细胞流式分析
总结与展望
PD-1治疗耐药是一个多因素、异质性的复杂难题,不存在单一的通用解决方案。已有研究显示,通过精准识别耐药机制并据此开发靶向联合疗法或新型多功能分子,是应对这一挑战的重要方向。我们提供的临床前药效评价服务,特别是基于药物机制开发的人源化动物模型的实验数据,有力验证了如TNG260、AK112等药物在克服特定类型PD-1耐药方面的潜力,为后续临床转化研究提供了关键支持。未来,我们将持续优化临床前评价平台,助力更多创新疗法从实验室走向临床转化。

