《Science》重磅:小胶质细胞替换疗法成功逆转致命脑病ALSP,首次实现小鼠与人类临床“双验证”
成人起病轴突膨胀伴色素胶质细胞脑白质病(Adult-onset leukoencephalopathy with axonal spheroids and pigmented glia,ALSP)是一种由CSF1R基因突变引起的罕见神经系统退行性疾病。CSF1R(集落刺激因子1受体)是影响小胶质细胞存活和功能的关键调控因子,其突变会导致患者出现小胶质细胞数量减少、功能异常,进而引发脑白质病变、轴突肿胀、钙化、运动障碍和认知退化等疾病表型。
目前,ALSP尚无治愈方法,疾病呈进行性加重,患者常在发病后10年内死亡。传统药物无法逆转或阻止疾病进展,因此亟需新的治疗策略。由于ALSP发病机制以小胶质细胞功能异常为核心,那么用健康的小胶质细胞替换病变细胞,是否能发挥“治本”的效果呢?
2025年7月,《Science》发表了一项突破性研究,研究团队首次在动物模型和患者中证实:通过小胶质细胞替换疗法替换致病的小胶质细胞,可有效阻止ALSP的进展。这项研究不仅填补了ALSP治疗领域的空白,也为其他神经退行性疾病的干预提供了全新策略。
ALSP小鼠模型的构建与MISTER策略
能够真实模拟患者临床表现和疾病进程的动物模型,是进行机制研究和疗效验证的基础。研究团队基于全球ALSP患者的突变谱,建立了两种携带CSF1R热点突变的小鼠模型(I792T和E631K),全面复现了ALSP的病理学和行为学特征,如小胶质细胞数量显著减少,脑钙化、髓鞘异常(高/低髓鞘化),轴突肿胀与球状体形成以及运动和认知功能障碍,为ALSP疾病的研究提供了可靠的动物疾病模型。早在2020年,该团队在《Cell Reports》发表里程碑式研究,首次提出“胶质细胞替换治疗”理念:用健康的小胶质细胞把病态的“原生清道夫”全部替换,并创新性地系统开发了三种替换路径——骨髓来源的小胶质细胞替换策略(Mr BMT)、外周血来源的小胶质细胞替换策略(Mr PB),以及脑区精准定点注射的替换策略(Mr MT)(图 1),首次使高效、可重复的小胶质细胞替换技术在实验室中得以常规化实现。同时在此基础上,团队提出了MISTER概念(microglia intervention strategy for therapy and enhancement by replacement),为神经系统疾病打造了一条“以旧换新”的细胞治疗快车道。
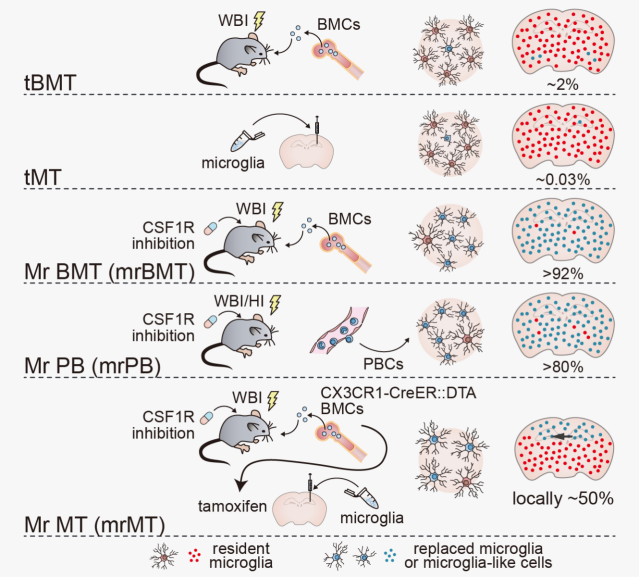
图1. 小胶质细胞替换治疗策略MISTER
Mr BMT治疗ALSP小鼠:基因修复带来全面改善
研究团队首先在新构建的疾病小鼠模型验证了基于骨髓来源的小胶质细胞替换策略(Mr BMT),该方案首先通过PLX5622药物清除小鼠脑内原有的小胶质细胞,随后移植来自健康供体小鼠的携带绿色荧光蛋白(GFP)标记的骨髓细胞。实验结果显示,移植细胞成功穿越血脑屏障,并分化为成熟小胶质细胞,实现了高达91.15%的替换效率(图2B)。替换后,模型小鼠脑组织中正常髓鞘的比例显著上升,异常髓鞘结构减少;轴突肿胀和轴索球样变明显减轻(图2C-E)。复合动作电位(CAP)记录进一步表明,神经信号传导速度得到恢复(图2G)。在行为学层面,小鼠在平衡木、转棒实验和Y迷宫等测试中的表现均显著改善(图2H-L)。这些结果一致表明,Mr BMT通过纠正CSF1R突变,全面逆转了ALSP的疾病表型。
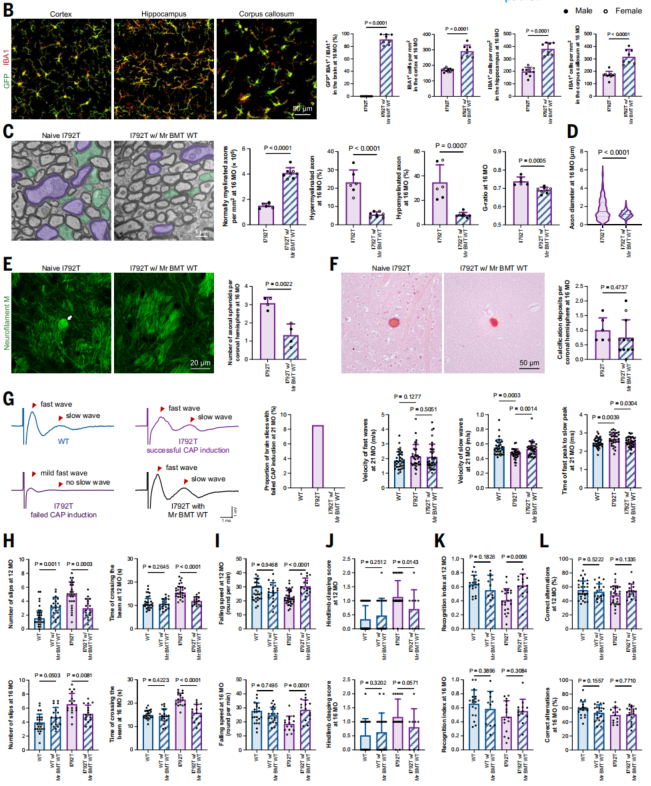
图2. 基于骨髓来源的小胶质细胞替换策略(Mr BMT)成功改善ALSP小鼠模型的病理及行为学表型
Mr BMT重塑CSF1R信号通路与少突胶质细胞表型
随后,研究团队通过单细胞测序分析深入解析了Mr BMT治疗后的细胞变化(图3)。结果显示,在突变型小胶质细胞中,CSF1R信号通路存在严重紊乱,关键基因如Fyn、Stat3等表达显著异常。而在接受Mr BMT治疗后,移植的健康小胶质细胞不仅恢复了CSF1R信号通路的正常表达,同时,少突胶质细胞的转录状态也从“ALSP主导型”逆转为“正常主导型”,呈现出接近野生型的细胞聚类特征。这些发现表明,小胶质细胞替代疗法不仅纠正了自身的功能异常,还通过细胞间通讯有效重塑了神经微环境,逆转了ALSP相关的全局性病理状态。

图3. 单细胞测序揭示Mr BMT治疗机制
传统骨髓移植策略(tBMT)在ALSP小鼠模型中同样有效
由于ALSP患者本身存在CSF1R功能缺陷,导致其内源性小胶质细胞在存活与竞争能力上处于劣势。基于这一背景,研究团队提出假设:是否无需额外使用清除剂,仅通过传统骨髓移植(tBMT)即可实现高效的小胶质细胞替换?
结果如图4所示,tBMT在ALSP模型小鼠中成功实现了84.08%的小胶质细胞替代率。进一步分析表明,移植后小鼠的髓鞘结构、轴突形态以及神经传导功能均得到显著改善,运动与认知行为表现也明显恢复,其整体疗效与Mr BMT相当。这些发现证实,在ALSP这类先天存在小胶质细胞竞争劣势的疾病中,tBMT本身即构成一种高效的小胶质细胞替代策略(MISTER),无需额外施加CSF1R抑制条件即可实现治疗水平的细胞替换。
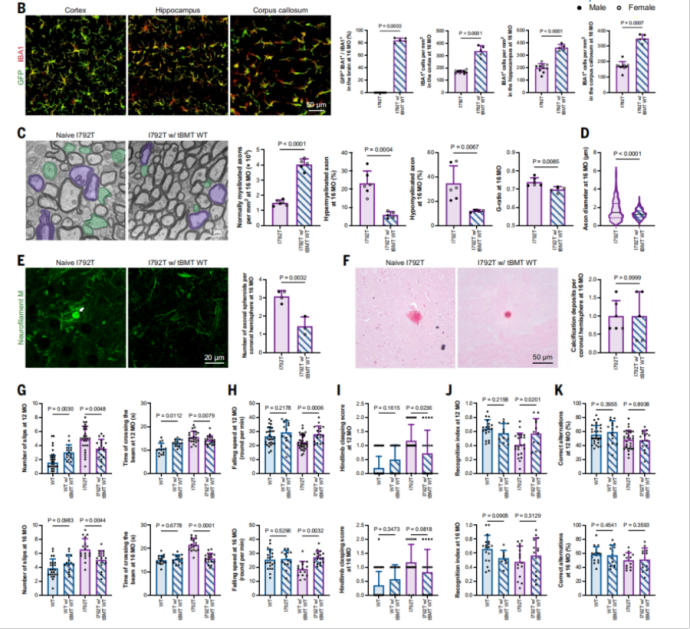
图4. 传统骨髓移植(tBMT)在ALSP小鼠模型中同样有效
从实验室到临床
凭借动物实验的突破性证据,研究团队迈出关键一步:为8名确诊ALSP的患者实施传统骨髓移植(tBMT)驱动的小胶质细胞替换,并展开长达两年的随访观察,率先将“小胶质细胞替换”策略推向临床。患者接受tBMT治疗后,¹⁸F-FDG PET显示脑葡萄糖代谢显著回升,提示小胶质细胞数量和活性的恢复;MRI证实脑萎缩与白质病变按下了“暂停键”;运动(UPDRS-III、ADL)与认知(MMSE、MoCA)功能在24个月内保持稳定。而未接受tBMT的对照组患者,其病情则持续恶化(图5)。tBMT成功阻止了ALSP的疾病进展;这是首次在人体临床试验中验证‘小胶质细胞替代疗法’的有效性。
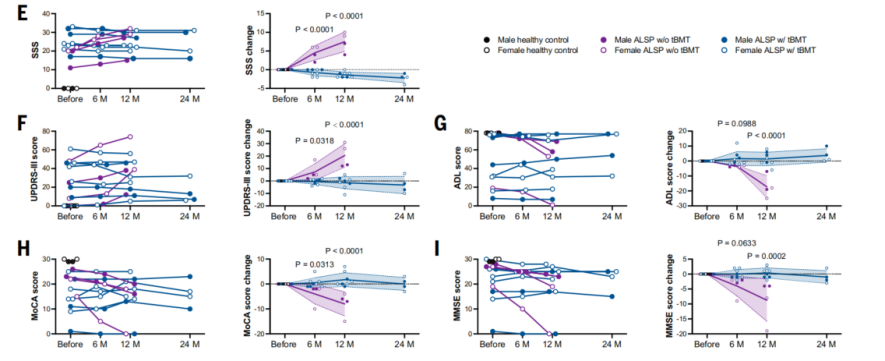
图5. 小胶质细胞替代疗法在ALSP患者中疗效的验证
前景与展望
这项研究首次实现了小胶质细胞替代疗法在疾病小鼠模型与人类患者中的同步验证,为ALSP的治疗带来了从“无药可治”到“可干预”的重大转变。更为重要的是,该研究表明现有成熟的骨髓移植(tBMT)技术无需复杂预处理即可直接用于ALSP患者,极大降低了临床转化的门槛。在此基础上,MISTER策略展现出广阔的应用前景,未来有望拓展至阿尔茨海默病、帕金森病等多种与小胶质细胞功能障碍相关的神经系统疾病。从机制层面来看,该疗法的有效性源于多重因素的协同作用:包括基因功能的纠正、移植细胞的竞争优势以及细胞内信号通路的重塑,这些发现共同为该策略的临床应用提供了坚实的理论依据(图6)。
不仅如此,该研究的价值远超单一罕见病治疗范畴,更是一项具有概念验证级别的重要突破。它系统完成了从精准动物模型构建、机制深入解析到最终临床应用的完整转化链条,充分体现了转化医学“从实验室到病床”的全流程研究范式。更重要的是,该研究彻底革新了神经退行性疾病“不可干预”的传统观念,开创了通过“细胞替代”策略重塑大脑微环境的新治疗领域,为多种神经退行性疾病的治疗开辟了全新方向。
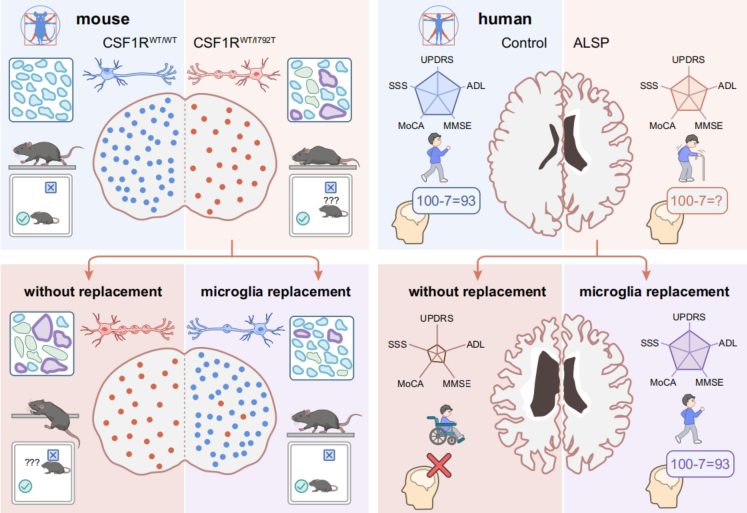
图6. 小胶质细胞替代疗法在ALSP疾病小鼠模型及患者中有效阻断疾病进展
参考文献
[1] Z. Xu et al., Efficient strategies for microglia replacement in the central nervous system. Cell reports32, 108041 (2020).
[2] Wu, Jingying et al. Microglia replacement halts the progression of microgliopathy in mice and humans. Science (New York, N.Y.) vol. 389,6756 (2025).

