Cell Reports Medicine丨东部战区总院刘志红院士团队发现中国汉族人群糖尿病肾病新致病基因TCN2

糖尿病肾病(DN)是2型糖尿病最常见的微血管并发症,也是导致终末期肾病的主要原因。该病表现出明显的家族聚集性和单核苷酸多态性(SNP)遗传力,但其具体的遗传风险机制尚不明确。以往针对糖尿病肾病的全基因组关联研究(GWAS)在识别遗传风险位点和估计遗传力方面成果有限,这可能是因为这些研究主要基于临床表型诊断的DN患者,而非经肾活检确诊的DN病例。此外,不同种族群体在DN发生和进展中存在差异,增加了遗传研究的复杂性,使得遗传位点难以在不同人群中得到一致验证。目前大多数DN的GWAS研究集中于非裔美国人或白人群体,针对中国汉族人群的研究仍较为缺乏,限制了我们对该人群DN发病机制的理解。
东部战区总医院,国家肾脏疾病临床医学研究中心刘志红院士领衔的研究团队在Cell子刊《Cell Reports Medicine》在线发表题为“Multimodal analysis stratifies the genetic susceptibility and reveals the pathogenic mechanism of kidney injury in diabetic nephropathy”的文章。研究联合国内12家单位,成功构建了目前全球最大规模、经肾活检明确诊断为DN的精准表型队列。以此为基础,首次绘制了中国汉族人群DN患者遗传图谱,发现了10个新的DN疾病风险SNP位点;其中5个具有很高的因果可能性,其中TCN2中的错义变异(p.K77M)是最佳候选者。随后的多维分析表明,与肾小管间质损伤相关的遗传变异是导致DN易感性的关键因素。此外,体外和体内实验证实,TCN2 p.K77M诱导线粒体功能障碍,在高糖条件下加剧肾小管细胞损伤。研究阐明了经活检证实的DN的遗传结构,并为其发病机制提供了新的见解。该研究使用的Tcn2-flox(C57BL/6JGpt-Tcn2em1Cflox/Gpt,T020717)和Tcn2-K77M(C57BL/6JGpt-Tcn2em1Cin(K77M)/Gpt)小鼠均由集萃药康制作。
建立精确表型的肾活检确诊DN队列和严格筛选的对照组
为了最大程度降低临床表型定义的DN队列中难以避免的其他肾脏疾病的干扰,采用了严格的临床与病理表型筛选方案,肾活检证实DN的患者作为DN组,以及诊断为10年以上无微量白蛋白尿、肾功能异常和DR的T2D患者作为T2D组,最终的DN组包括2,279名经肾活检证实的DN的无关患者。对于T2D组,筛查了15,895 名被诊断患有糖尿病且10年以上且无任何微血管并发症的患者。通过眼底照相和肾功能评估(例如估计肾小球滤过率(eGFR)和尿白蛋白与肌酐比值(UACR))确定T2D患者是否存在微血管并发症。此外,我们还招募了一个HC组,该组由3,970名没有糖尿病和肾脏疾病的人组成。最终研究人群包括10,011名不相关的参与者,包括2,279名DN患者、3,762名T2D患者和3,970名健康个体。
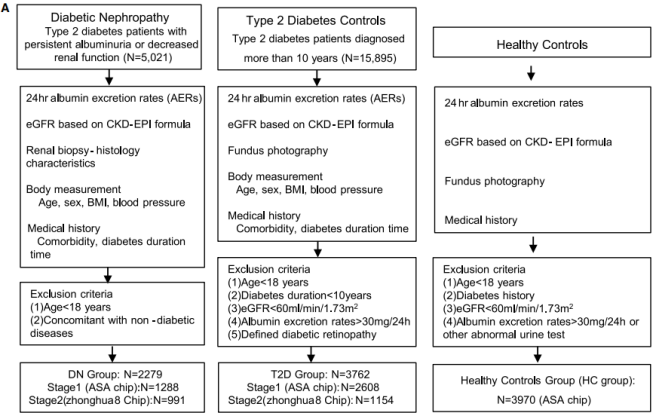
图1. 选择糖尿病肾病组(DN组)、2型糖尿病对照者(T2D组)和健康对照者(HC组)的过程
两阶段GWAS设计和Meta分析
通过两阶段GWAS分析,发现了10个达到全基因组显著水平的DN遗传易感位点,并且新发现的位点与既往DN GWAS研究结果存在显著差异,不仅提示中国汉族人群可能具有独特的DN遗传易感背景,也有力地支持了精准表型DN队列在揭示核心致病位点上的优势。结果显示,免疫系统紊乱和消化系统紊乱显着富集。这种富集主要是由位于HLA位点附近的遗传变异以及PSORS1C1、TCN2和EEF1D位点驱动的。
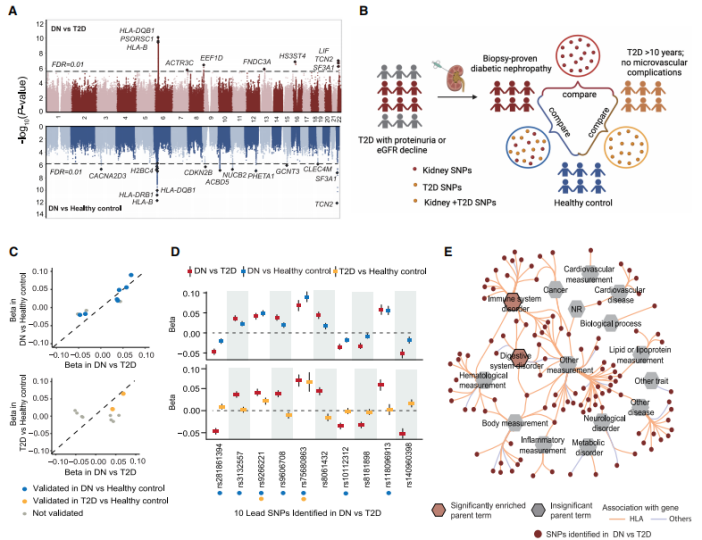
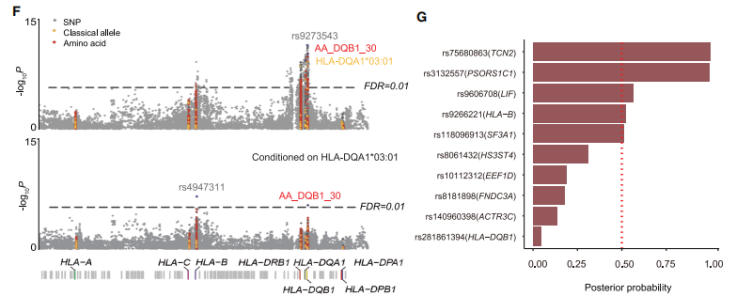
图2. Stepwise GWAS与post-GWAS分析
精细定位和因果变异推断
研究在GWAS分析中,与T2D相比,包括HLA-DQB1和HLA-B在内的几个HLA等位基因显示出与DN的显着关联。因此,进一步关注HLA区域中最重要的关联信号,以确定T2D中DN易感性的潜在致病变异。应用了FINEMAP在GWAS中确定的10个提示性位点中优先考虑DN与T2D的变异,这些变异可能在单变异水平上是因果关系。在这10个基因座中,有5个因果关系的概率大于50%。后验概率大于99%的是TCN2外显子2中的错义变异(rs75680863;c. 230A>T;p.K77M)。
与临床特征相关的致病变异的基因型和肾组织表达
为了评估5种致病变异的临床相关性,研究者检查了它们与DN中肾损伤标志物的相关性,特别是eGFR和蛋白尿。效应等位基因rs75680863和rs118096913与蛋白尿增加相关,支持这两种变异的致病作用,而其他三种候选致病变异与蛋白尿没有显着关联。分析表明,肾小管TCN2 mRNA表达与eGFR呈正相关,但与蛋白尿呈负相关,表明TCN2对DN患者具有肾保护作用。相反,PSORS1C1、LIF和HLA-B的较高表达水平与eGFR降低和蛋白尿增加相关,表明这些基因的较高表达可能有助于疾病进展。这些结果凸显了这些候选位点及其相关基因在DN肾功能恶化中的重要性。
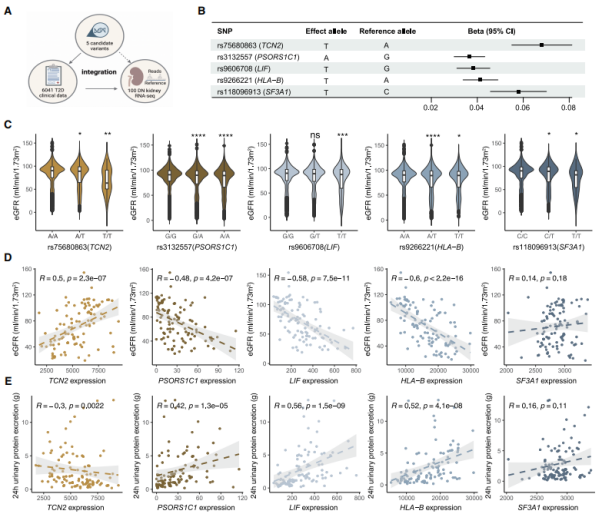
图3. 五个优先基因位点与 DN 临床特征的基因型和肾脏组织表达关联
与肾脏病理特征相关的致病变异的基因型和肾组织表达
肾脏形态学是DN的诊断和预后金标准。评估了精细定位的位点是否影响了1,891名DN患者的DN肾脏病理学,并提供了可用的病理数据。通过比较每个候选变异的基因型类别中每个病理类别的比例,我们确定间质纤维化和肾小管萎缩(IFTA)和间质炎症严重程度与变异基因型表现出显着关联(p<0.05)。rs75680863(TCN2)基因型显示出最强的IFTA关联。
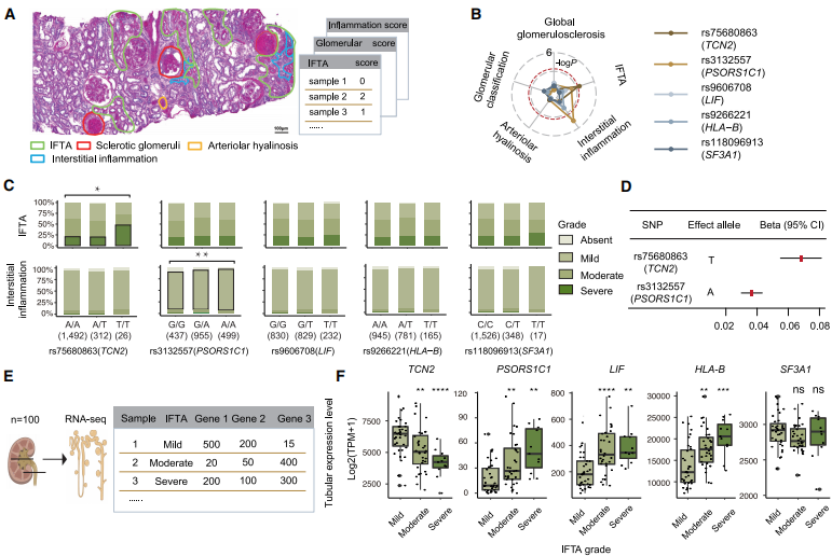

图4. 优先基因位点的基因型和肾脏组织表达与肾脏病理特征之间的关联
构建TCN2条件性敲除和TCN2 p.K77M点突变小鼠模型
具体而言,TCN2主要在近端肾小管细胞和内皮细胞中表达,在DN下显著下调。多模式方法将转录谱与DN病理学联系起来,优先考虑以TCN2为例的遗传风险特征。rs75680863是TCN2基因外显子2的错义突变(c.230A>T, p.Lys77Met),是DN的关键风险位点。为了进一步探讨rs75680863(TCN2 p.K77M)在DN发育中的作用,研究者建立了Tcn2-K77M突变小鼠模型与Tcn2条件性敲除小鼠模型,并诱导其发展为糖尿病肾病模型,发现Tcn2的敲除或点突变能够加重小鼠的糖尿病肾病相关表型。
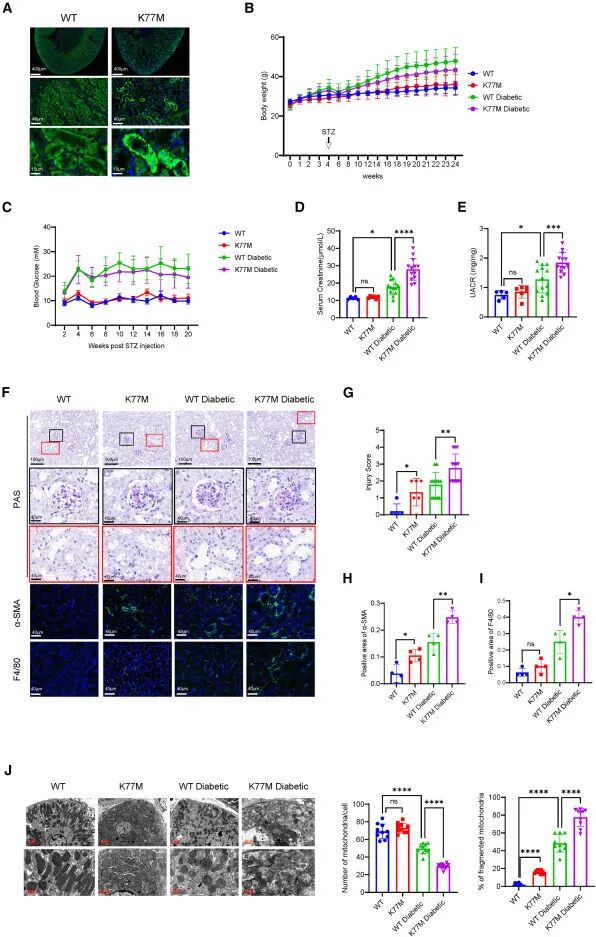
图5. TCN2 K77M小鼠及其糖尿病模型的表型及病理变化
线粒体功能测定和蛋白质组学分析
与WT小鼠相比,Tcn2-K77M小鼠线粒体蛋白表达降低,包括线粒体复合物亚基、线粒体核糖体蛋白、线粒体膜蛋白和线粒体合酶。这些蛋白质在WT糖尿病和Tcn2-K77M糖尿病小鼠中持续下调。这些发现表明,在高糖条件下,线粒体在Tcn2-K77M小鼠的管状细胞中受损并失调。
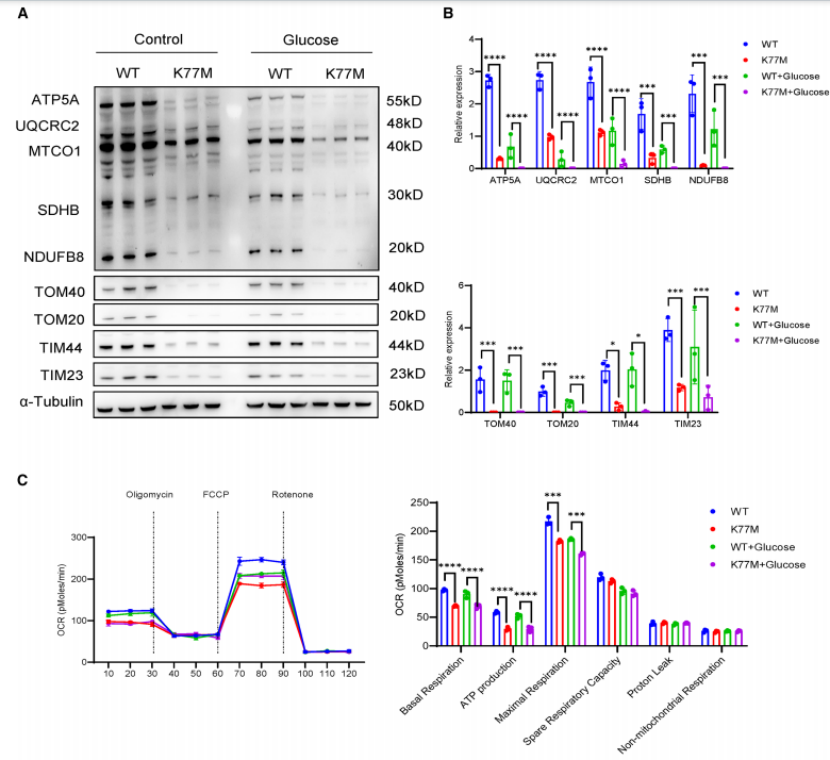
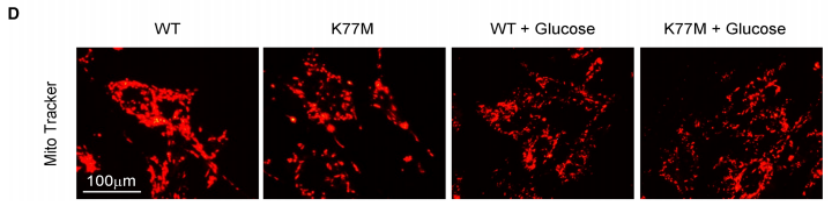
图6. TCN2效应等位基因加剧高糖条件下肾小管细胞的线粒体缺陷
综上所述,这些发现为理解中国汉族人群DN的发病机制提供了新见解,并为DN的精准诊断和治疗提供了潜在靶点。研究建立的精确表型筛选方法和多维度分析策略也为其他复杂疾病的遗传研究提供了重要参考。

