实验稳定性不好,可能是你的转基因小鼠模型没选对
实验稳定性关乎着结论的可靠性和可重复性。动物实验必须设计良好、符合伦理、有效执行、正确分析、清晰呈现,并正确解释,所获得的结论才能被学界接受和认可。那么,转基因小鼠等小鼠模型的选择为什么会影响到实验的稳定性?集萃药康为您解读。
近交系动物-有效控制动物模型的稳定性
近交系动物-有效控制动物模型的稳定性
近交系(Inbred strain),又称为纯系动物,由于长期近亲繁殖,它们在基因型上几乎相同。如BALB/c小鼠、C57BL/6J小鼠等。近交系的极高均一性,可实现使用更少的个体产生具有相同统计显著性水平的结果。有文献分析五个近交系(inbred strain)小鼠和两个远交系(outbred strain)小鼠在环己巴比妥麻醉下的睡眠时间的平均值和标准差,发现远交系的组内差异远大于近交系,形成统计学差异所需的组内动物接近近交系的10倍。
此项研究也进一步证明:基因型的一致对实验样本量和实验结果的稳定性起到至关重要的作用。
表1.基因型的均一性在确定实验样本量中的重要性
(近交系与远交系小鼠在环己巴比妥麻醉实验中的睡眠时间)
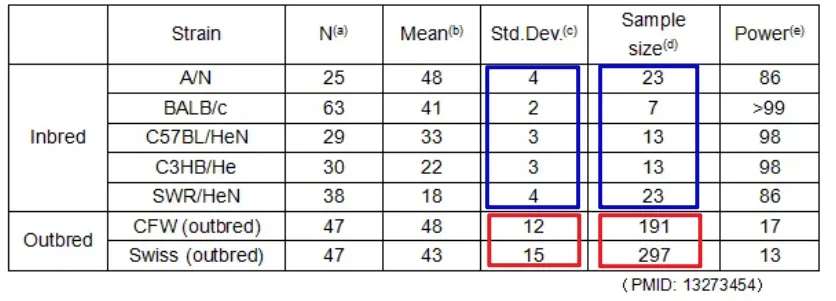
(a) 入组动物数目
(b) 平均睡眠时间Mean sleeping time
(c) 睡眠时间标准差,该值越低则代表组内数据越稳定。
(d) 满足标准统计差异性分析所需样本量,在4分钟以上差异比较中的双样本 t 检验中显示5%的显著性差异(p-value)和90%的统计功效(power of test)。该值越低则代表组内数据越稳定,越容易获得统计学差异。
(e) 睡眠时间差异4分钟以上的差异比较的统计功率(样本量固定为20小鼠/组)。该值越高代表获得统计学结论的可靠性越高。
四倍体补偿技术对实验稳定性的影响
四倍体技术,是最近较热门的一种新兴技术。小鼠正常2细胞期胚胎(二倍体)经过电脉冲可融合形成四倍体胚胎,四倍体胚胎具有发育缺陷,只能发育形成胚体以外的组织结构,如胎盘、脐带等,而胚胎干细胞(Embryonic stem cell, ESc)能够分化形成体内所有的细胞类型。因此四倍体技术可获得完全来自于ESc遗传的F0代小鼠(而不是嵌合鼠),甚至在F0代获得纯合中靶小鼠。这看似加速了转基因动物获得纯合动物的进程。然而,大量的文献显示,四倍体技术会出现移植生仔率低(存活率:5.6%和3.1%)(表2)和动物发育不全的问题。
表2. 四倍体技术在C57BL/6N和BALB/c两种背景的ES细胞上获得存活动物的成功率
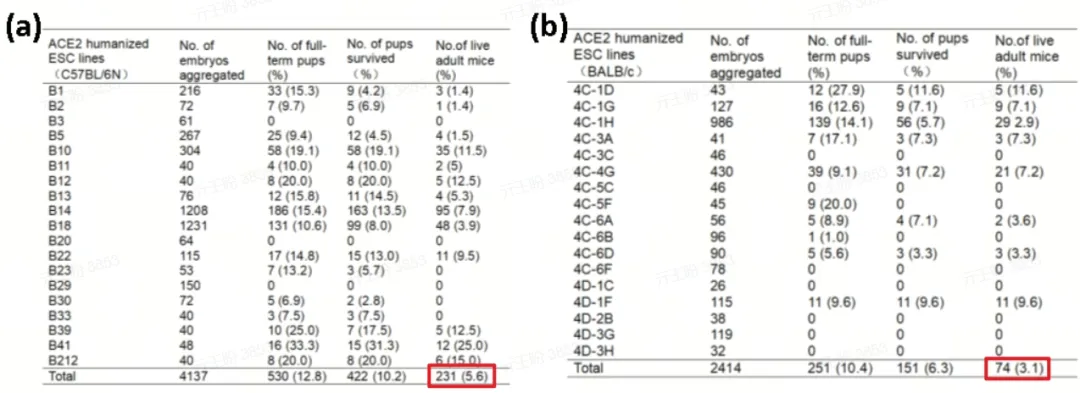
(PMID: 34676093)
(a) C57BL/6N背景多个ES克隆的数据,(b) Balb/c背景多个ES克隆的数据
为了控制转基因方式所带来的遗传和表型变量,通常会将F0动物与近交系背景动物多次繁育以稀释和去除遗传变量并获得纯系,这个过程称为Backcross(回交),以此获得携带目标遗传修饰的且具有稳定的遗传背景的纯系转基因动物(如下图)。因此,如果将四倍体补偿技术获得的F0代小鼠直接用于动物实验,风险是不可控的!!!
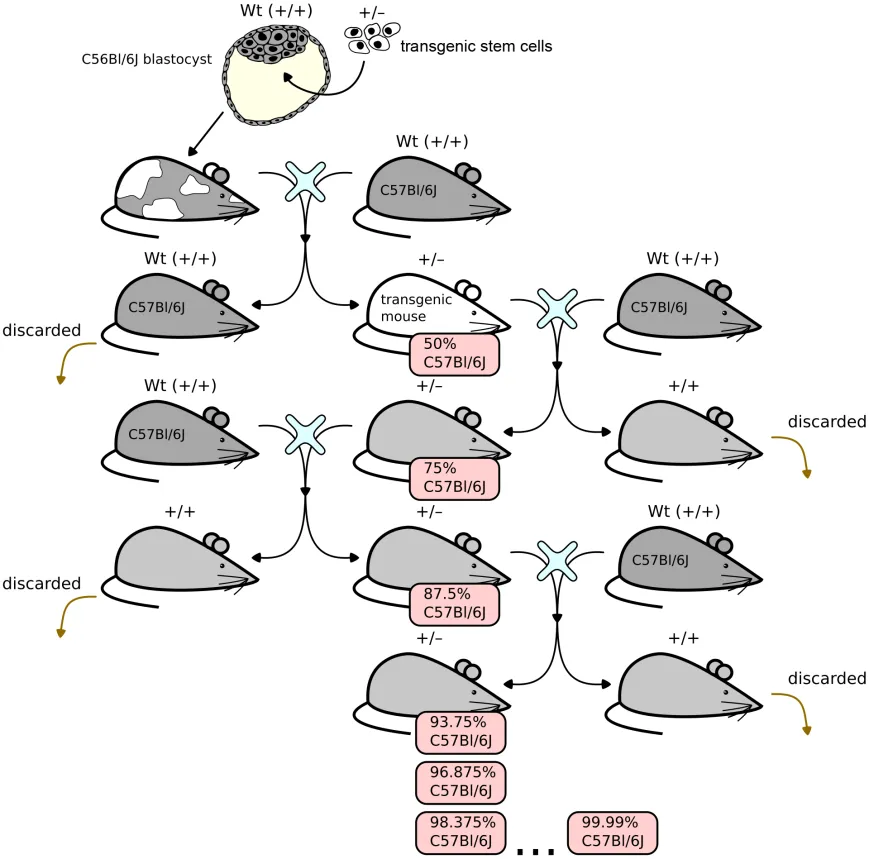
(图片修改自维基百科)
图1. Backcross(回交)以去除转基因动物制备带来的遗传变量
集萃药康为最 大程度保障实验中使用的动物模型的稳定性,通常交付可稳定遗传的F1代小鼠,为各位的科研工作保驾护航!
集萃药康拥有成熟的基因编辑技术,可构建转基因、基因敲除、基因敲入等各类基因编辑小鼠模型,目前已完成22000+个基因编辑小鼠模型构建,可以为客户提供现货模型产品、模型定制、模型联合研发等服务。同时,集萃药康基于成熟的手术操作技术、标准化药物诱导流程可为客户提供各种小鼠/大鼠模型定制服务。如您对模型定制感兴趣,可联系官方客服。
参考文献
1. Jay Jr, G. E. (1955). Variation in response of various mouse strains to hexobarbital (Evipal). Proceedings of the Society for Experimental Biology and Medicine, 90(2), 378-380.
2. Miles, B., & Tadi, P. (2020). Genetics, somatic mutation.
3. Cervantes, R. B., Stringer, J. R., Shao, C., Tischfield, J. A., & Stambrook, P. J. (2002). Embryonic stem cells and somatic cells differ in mutation frequency and type. Proceedings of the national academy of Sciences, 99(6), 3586-3590.
4. Sugawara, A., Goto, K., Sotomaru, Y., Sofuni, T., & Ito, T. (2006). Current status of chromosomal abnormalities in mouse embryonic stem cell lines used in Japan. Comparative medicine, 56(1), 31-34.
5. Gaztelumendi, N., & Nogués, C. (2014). Chromosome instability in mouse embryonic stem cells. Scientific Reports, 4(1), 5324.
6. Yang, H., Ren, S., Yu, S., Pan, H., Li, T., Ge, S., ... & Xia, N. (2020). Methods favoring homology-directed repair choice in response to CRISPR/Cas9 induced-double strand breaks. International journal of molecular sciences, 21(18), 6461.
7. Liu, F. L., Wu, K., Sun, J., Duan, Z., Quan, X., Kuang, J., ... & Chen, J. (2021). Rapid generation of ACE2 humanized inbred mouse model for COVID-19 with tetraploid complementation. National Science Review, 8(2), nwaa285.

