
huHSC-NCG-M
为提高人源免疫细胞的植入,集萃药康将人类编码干细胞因子(SCF,又称KITLG)、粒细胞/巨噬细胞集落刺激因子2(GM-CSF,又称CSF2)以及白细胞介素-3(IL-3)的基因导入到NCG小鼠上,获得的NCG-M人源化小鼠模型可以更好的促进髓系细胞的扩增,并提高患者来源急性髓系白血病细胞的植入效率。
应用领域
1. 支持CD34+造血干细胞移植后小鼠体内多谱系人源免疫细胞的重建,包括髓系细胞和调节性T细胞群;
2. 用于建立急性髓系白血病(AML) PDX(患者源性异种移植)小鼠模型;
3. 接种人源肿瘤用于筛选相关药物;
4. 细胞因子风暴和免疫毒性反应研究。
验证数据
1. NCG-M小鼠中人源CSF2、IL3、KITLG表达检测
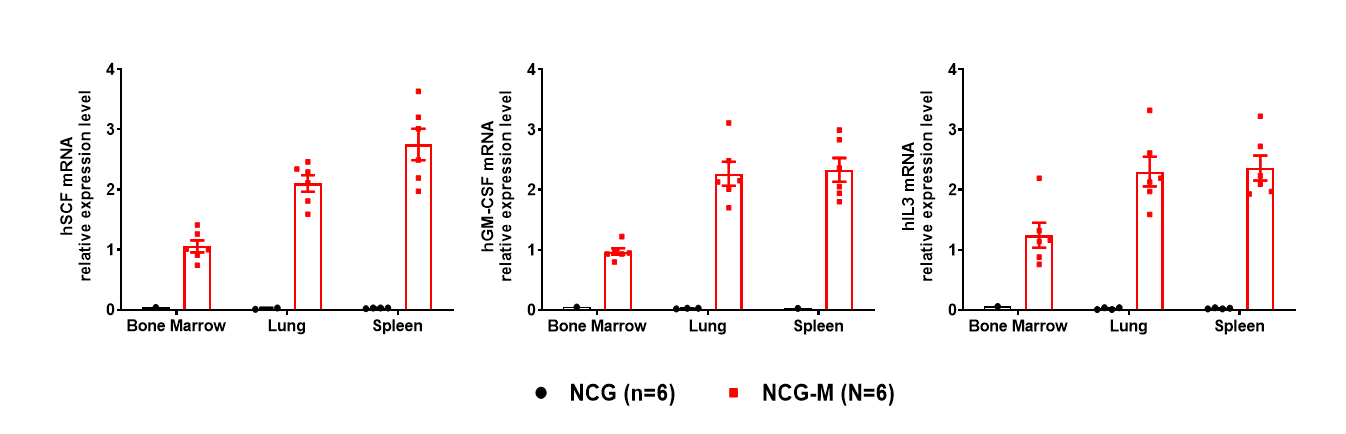
图1. NCG和NCG-M小鼠中人源CSF2、IL3、KITLG mRNA表达水平检测
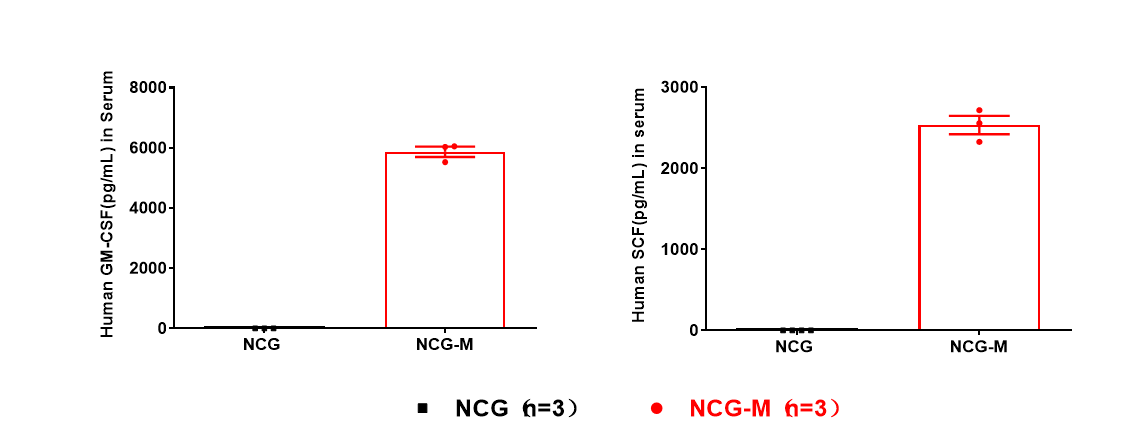
图2. NCG和NCG-M小鼠血清人源CSF2和KITLG蛋白表达水平检测
NCG背景鼠中未检测到人源CSF2、IL3和SCF mRNA表达,NCG-M小鼠各组织中能检测到人源CSF2、IL3和SCF mRNA的表达(图1)。NCG-M小鼠外周血血清中可检测到人源GM-CSF和SCF的蛋白表达,人源IL3蛋白表达检测值低于Elisa检测下限,其表达量较低。但免疫健全小鼠在未刺激的生理水平下也难以检测到外周血中mIL3的蛋白表达,结合检测到的各组织hIL3的mRNA转录水平,推测hIL3以低水平表达的方式在体内发挥功能。
2. huHSC-NCG及huHSC-NCG-M小鼠免疫重建表型
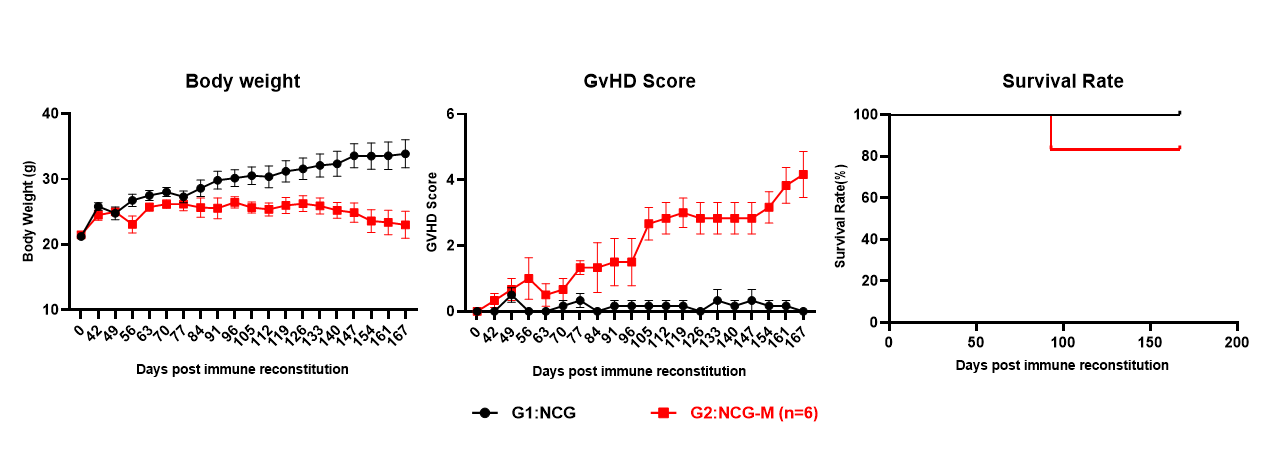
图3. huHSC-NCG和huHSC-NCG-M小鼠的体重变化、GvHD评分及生存曲线情况
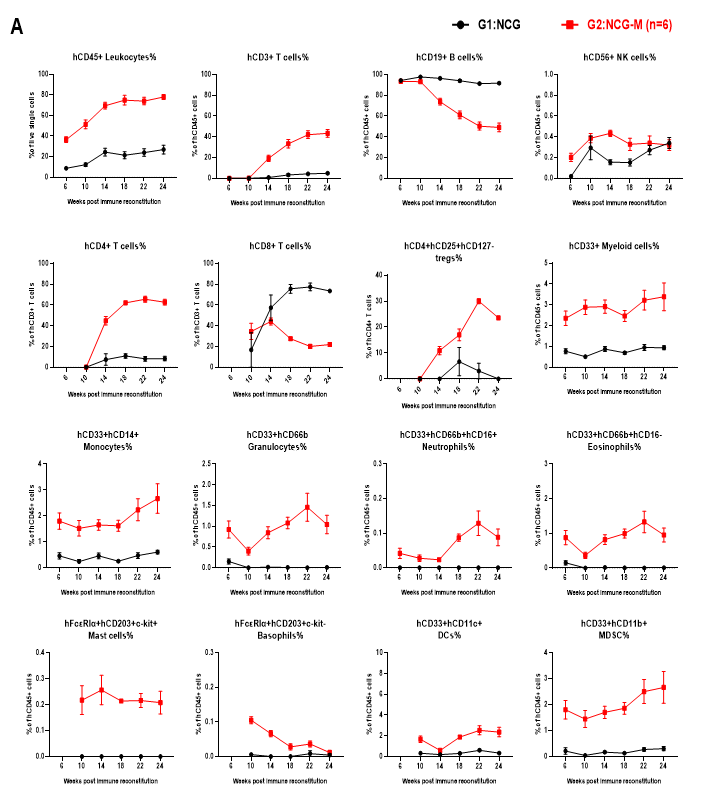
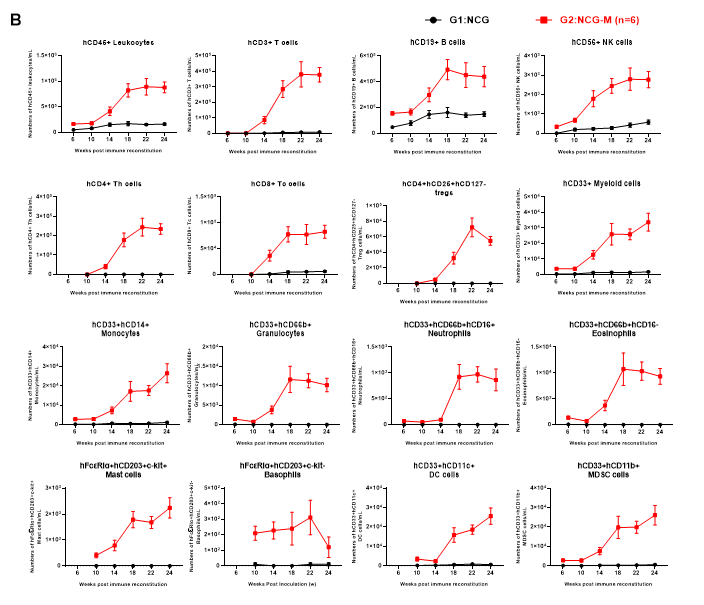
图4. huHSC-NCG和huHSC-NCG-M小鼠外周血中各细胞组份的重建情况
NCG与NCG-M小鼠辐照清髓后尾静脉接种5×104 CD34+造血干细胞移植,在重建后6、10、14、18、22和24周收集huHSC-NCG及huHSC-NCG-M小鼠外周血,采用流式细胞技术检测huHSC-NCG小鼠及huHSC-NCG-M小鼠人源化进程。与huHSC-NCG免疫重建小鼠相比,huHSC-NCG-M能够重建出更高水平的人源白细胞,且重建的免疫细胞谱系更多样化,尤其是能够产生hCD33+髓系细胞和hCD14+hCD33+单核细胞群。
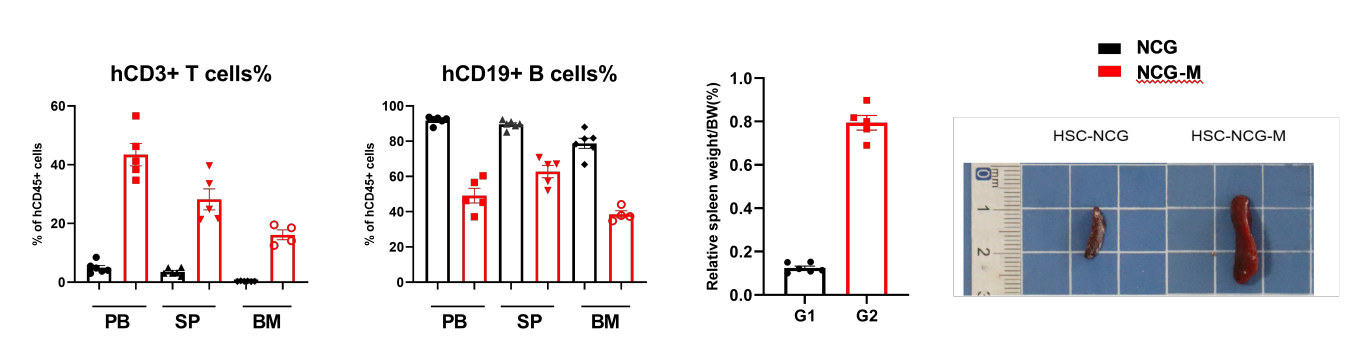
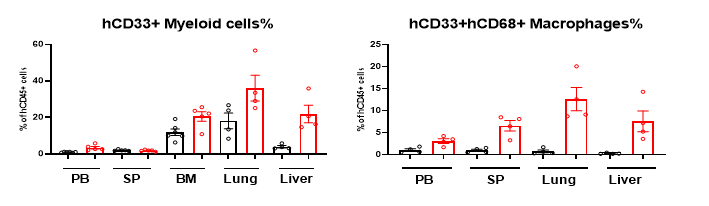
图5. huHSC-NCG和huHSC-NCG-M小鼠组织中人源免疫细胞重建情况
HuHSC-NCG-M小鼠中重要的次级淋巴器官脾脏得到更好地重建,脾脏的体积和重量(脏体比)相较于huHSC-NCG小鼠得到明显的提升。且脾脏中hCD3+T细胞占比增加,更接近于人体脾脏T细胞比例。
相较于huHSC-NCG小鼠,huHSC-NCG-M小鼠骨髓髓系细胞细胞占比显著增加,NCG-M可通过促进骨髓中人源髓系祖细胞的发育分化从而促进各髓系细胞群体的发育分化。且在非免疫组织肺和肝脏中检测到显著增加的重建人源髓系细胞,尤其是组织驻留的巨噬细胞的占比。
3. huHSC-NCG-M小鼠生存曲线
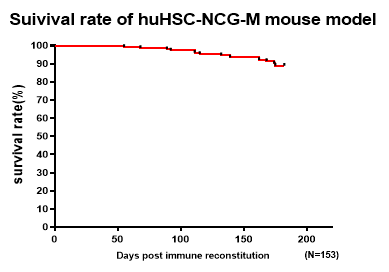
图6. huHSC-NCG-M小鼠生存曲线情况
4-6w的NCG-M雌性小鼠辐照后尾静脉接种4×104 hCD34+造血干细胞进行免疫重建,不同Donor移植且人源化构建成功(重建6w外周血hCD45%>25%)的huHSC-NCG-M小鼠在重建26w生存率仍可达到90%左右,在满足更高水平重建率和更丰富免疫细胞群体重建的同时,有较长的生存周期,满足绝大多数药效实验窗口期。
参考文献
1. Shultz LD, Schweitzer PA, Christianson SW, et al. (1995). "Multiple defects in innate and adaptive immunologic function in NOD/LtSz-scid mice". J. Immunol. 154 (1): 180.
2. Takenaka K, Prasolava TK, Wang JC, et al. (2007). "Polymorphism in Sirpa modulates engraftment of human hematopoietic stem cells". Nat. Immunol. 8 (12): 1313.
3. Cao X, Shores EW, hu-Li J, et al. (1995). "Defective lymphoid development in mice lacking expression of the common cytokine receptor gamma chain". Immunity. 2 (3): 223.
4. Nicolini, F. E., et al. (2004). "NOD/SCID mice engineered to express human IL-3, GM-CSF and Steel factor constitutively mobilize engrafted human progenitors and compromise human stem cell regeneration." Leukemia 18 (2): 341.
5. Curtis, Benson M., et al. (1991). "Enhanced hematopoietic activity of a human granulocyte/macrophage colony-stimulating factor-interleukin 3 fusion protein." Proceedings of the National Academy of Sciences 88 (13): 5809.
6. Feuring-Buske, M., et al.(2003). "Improved engraftment of human acute myeloid leukemia progenitor cells in beta 2-microglobulin-deficient NOD/SCID mice and in NOD/SCID mice transgenic for human growth factors." Leukemia 17 (4 ) :760.
7. Wunderlich, M., et al. (2010). "AML xenograft efficiency is significantly improved in NOD/SCID-IL2RG mice constitutively expressing human SCF, GM-CSF and IL-3." Leukemia 24 (10): 1785.

