集萃成章|汪红英团队新发现-PAR2信号激活可促进结直肠癌转移
肿瘤转移是引起癌症死亡的主要原因,在转移性器官中促使肿瘤定植有两个协同驱动因素,细胞可塑性和免疫逃逸,使得肿瘤细胞在免疫抑制微环境中,与免疫细胞与基质细胞相互作用,支持肿瘤细胞生长并逃避免疫系统的监视。结直肠癌是最常见的消化道肿瘤,其肝转移率较高,且预后不良。
近年来,随着靶向治疗的发展,许多晚期癌症患者的预后得到显著改善,但结直肠癌患者收效甚微。蛋白酶激活受体2(PAR2)是G蛋白偶联受体家族的一员,其与转移性结直肠癌的发生密切相关,能够增强癌症干细胞的自我更新并促进癌细胞转移。然而,PAR2在调节肿瘤微环境中的作用还知之甚少。
2024年1月1日,中国医学科学院肿瘤医院汪红英团队在Cancer Letter杂志发表题为Bcl-xL mediates interferon-beta secretion by protease-activated receptor 2 deficiency through the mitochondrial permeability transition pore in colorectal cancer metastasis的文章。该研究发现蛋白酶活化受体2(PAR2)信号通过稳定线粒体膜,在结直肠癌肝转移过程中通过IFN-β调节免疫微环境,而PAR2抑制剂和免疫检查点抑制剂(ICB)的协同作用为转移性结直肠癌治疗提供潜在的治疗策略。

该研究使用了来自集萃药康的Ifnar1-KO(Strain NO. T005534)小鼠
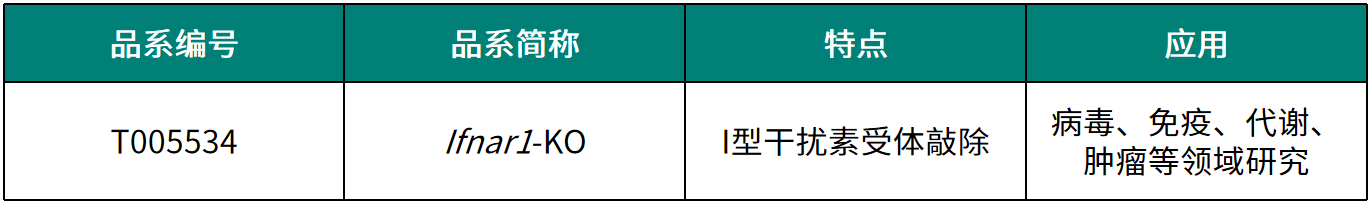
研究团队首先比较了免疫功能正常与缺陷小鼠肿瘤细胞的转移能力,发现相较于免疫缺陷小鼠,敲低PAR2能够显著降低免疫正常小鼠中结直肠癌细胞的转移数量,且肝脏中CD8 T细胞与IFNγ水平显著升高。表明PAR2信号通过Ⅰ型IFN信号通路调节转移器官中的免疫微环境。
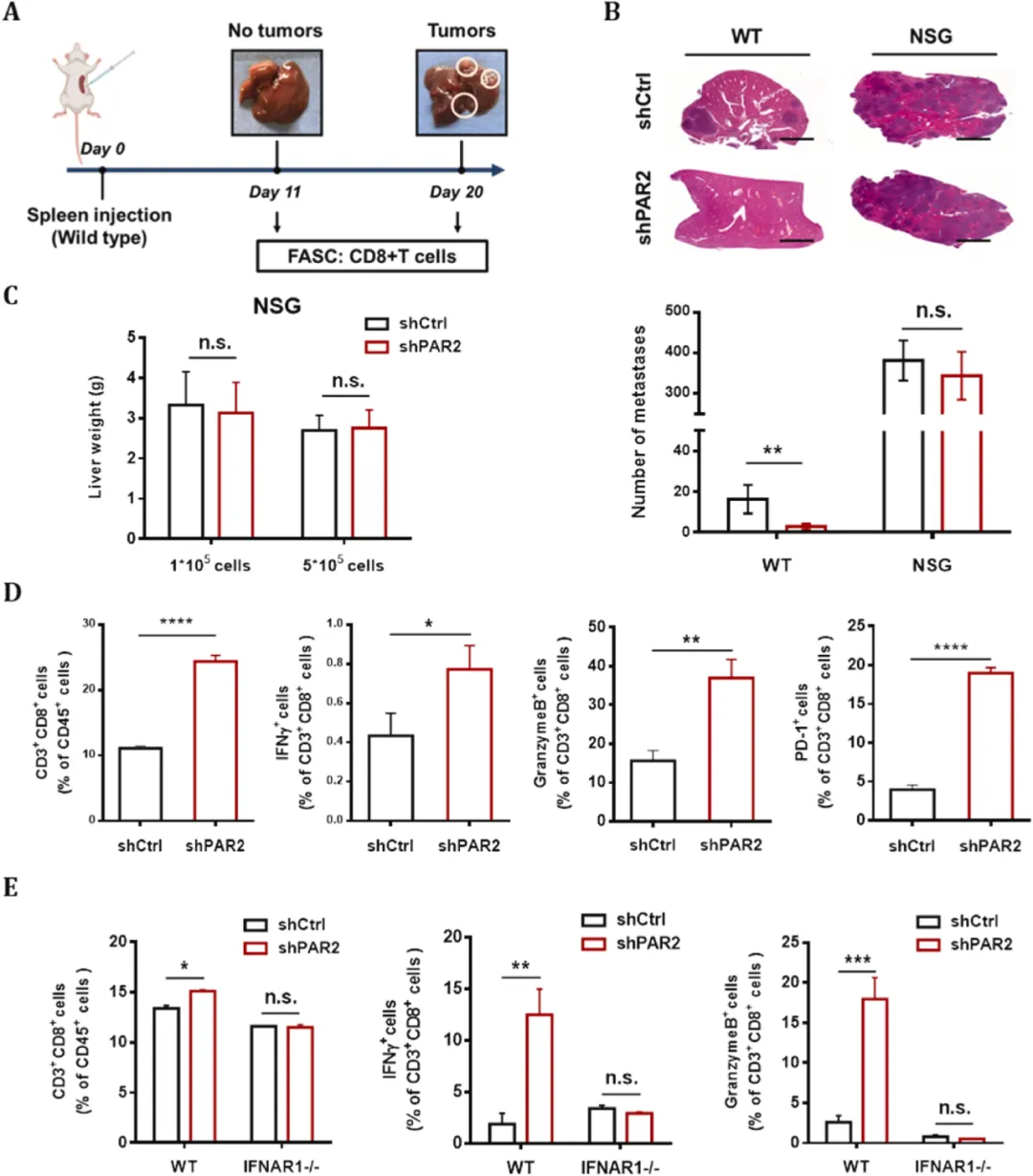
图1 PAR2通过I型干扰素信号通路介导结肠直肠癌的肝转移
由于PAR2信号在结直肠癌细胞中被自分泌信号激活,研究团队在不同的结直肠癌细胞中分别敲低PAR2并进行转录组测序,发现Ⅰ型IFN信号通路中的基因表达水平均上调,其中IFN-β表达增加,STAT磷酸化水平增加,TBK-1与IRF3被激活,若敲低STING或RIG-1则能够部分逆转这一上调。这些结果表明,PAR2缺失通过cGAS/STING和RIG-1信号通路上调IFN-β并激活Ⅰ型IFN信号转导。
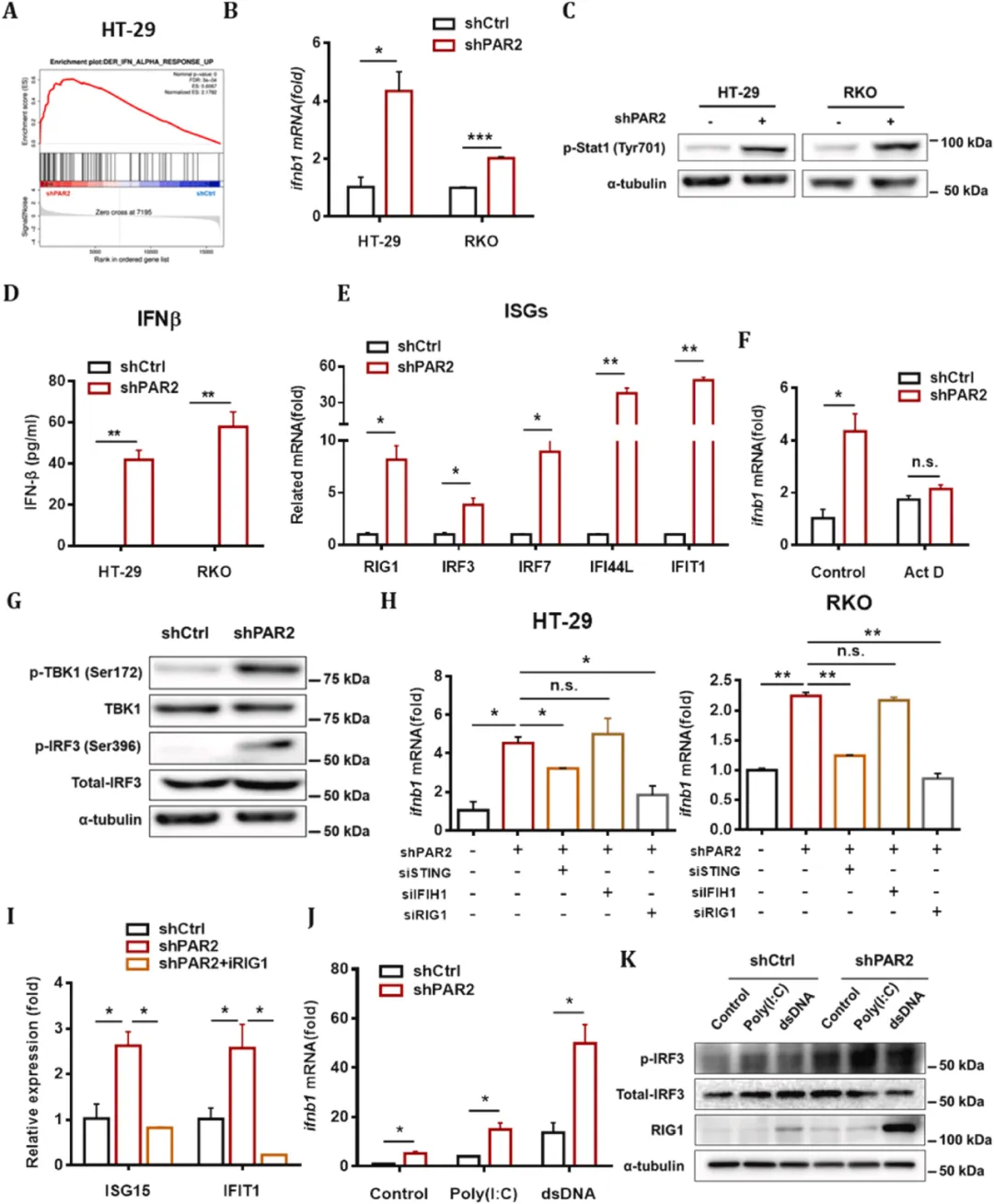
图2 PAR2缺失激活I型IFN信号通路
线粒体DNA在胞质中的积累能够激活cGAS/STING和RIG-1通路。研究团队此前发现PAR2能够稳定线粒体凋亡通路中的Bcl-xL,通过检测敲低PAR2细胞中的线粒体形态和膜电位,发现PAR2缺失会破坏结直肠癌细胞的线粒体稳态。此外,研究团队使用扎西他滨处理线粒体DNA缺失细胞Rho0后发现,敲低PAR2无法上调Ifnb1的表达。这些发现表明,PAR2缺失会增加线粒体DNA的胞质积累,引起结直肠癌中Ifnb1的上调。
图3 PAR2缺失刺激线粒体核酸泄漏
线粒体通透性转换孔(mPTP)是一种位于线粒体内膜与外膜之间的蛋白复合物,是核酸外排的非特异性通道。研究团队发现在PAR2缺陷细胞内BAK和BAX的表达与线粒体定位显著增加,而回补Bcl-xL后能够逆转PAR2缺失引起的Ifnb1上调,消除T细胞活化,表明PAR2通过Bcl-xL调节线粒体膜通透性,最终影响CD8 T细胞的活化。
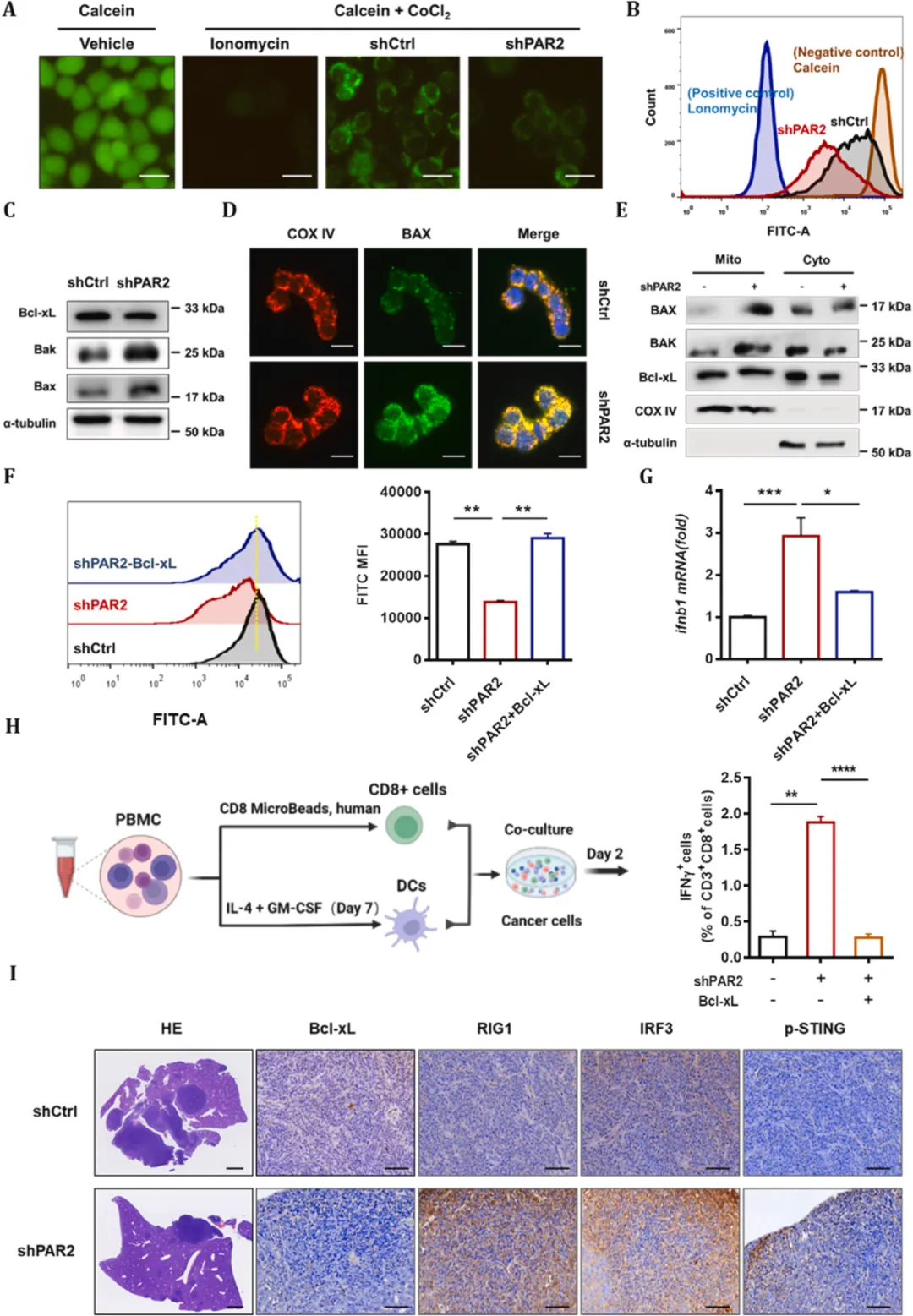
图4 PAR2通过Bcl-xL调控线粒体膜通透性
在结直肠癌细胞中抑制PAR2能够招募更多的CD8 T细胞至转移器官,这些细胞能够表达活化及免疫抑制标志物在小鼠肝转移瘤的肿瘤细胞内高表达。研究团队利用PAR2抑制剂与抗PD-L1抗体联合处理结直肠癌肝转移小鼠,发现小鼠肝脏中的转移病灶显著减少,且CD8 T细胞的百分比显著增加,表明PAR2抑制剂和免疫检查点抑制剂对结直肠癌的肝转移有协同作用。
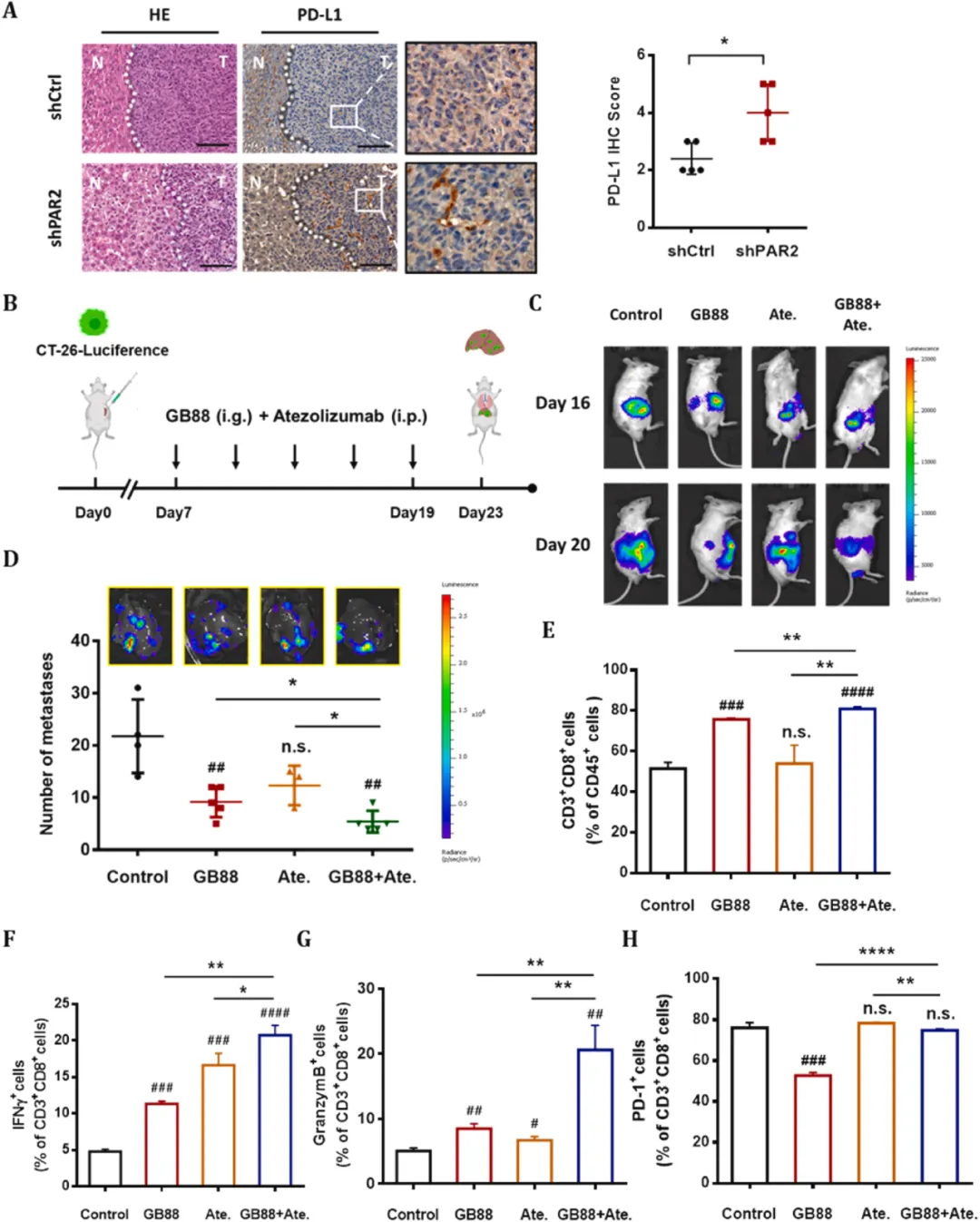
图5 PAR2抑制剂增加ICD治疗的敏感性
综上所述,研究团队证明了在结直肠癌细胞中高度表达的PAR2通过抑制Ⅰ型IFN通路以形成免疫抑制微环境。癌细胞中的PAR2信号缺失降低了Bcl-xL的表达,增加线粒体膜通透性,使得线粒体DNA在胞质中积累,并诱导I型IFN信号转导,从而引发抗肿瘤免疫。进一步地,研究者通过小鼠体内给药实验,证明了PAR2抑制剂与免疫检查点抑制剂存在协同作用,能够进一步抑制结直肠癌的转移,为晚期结直肠癌患者的治疗提供了一种新策略。