PD1耐药模型助力黄子隽/于君团队揭秘肠道细菌如何促进肠癌发生及耐药
目前,越来越多的研究表明,肠道微生物群调节宿主对药物治疗的反应。Bertrand routy等发现,嗜黏蛋白阿克曼菌可以影响非小细胞肺癌患者和肾癌患者对PD-1的相应。然而,关于肠道微生物是否以及如何调节靶向治疗的信息还很匮乏。PD1耐药模型的出现对于研究PD1/PD-L1免疫疗法的耐药机制、探索克服耐药性的新策略具有重要意义。
2024年7月,黄子隽/于君团队发表题为Peptostreptococcus stomatis promotes colonic tumorigenesis and receptor tyrosine kinase inhibitor resistance by activating ERBB2-MAPK的文章。
研究显示,Peptostreptococcus stomatis (P. stomatis) 通过激活ERBB2-MAPK促进结肠肿瘤发生,影响EGFR类抑制剂(西妥昔单抗,厄洛替尼)对酪氨酸激酶受体的拮抗作用,并且可削弱BRAF抑制剂(维莫非尼)的治疗效果。
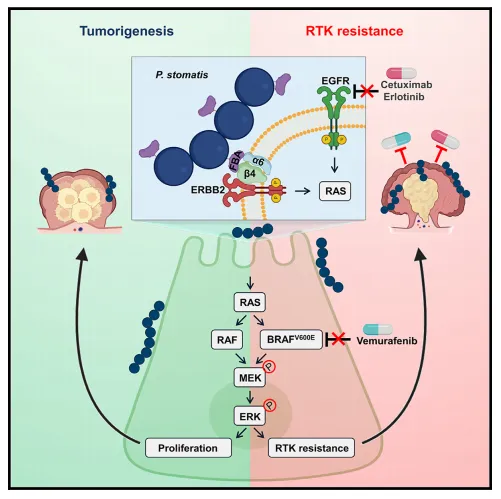
前期临床样本的研究结果显示,消化链球菌(P. stomatis)会在结直肠癌患者的粪便和黏膜样本中富集。在AOM-DSS诱导的结直肠癌小鼠以及自发肿瘤的ApcMin/+模型中,灌胃P. stomatis后都加速了肿瘤的产生。这表明P. stomatis是影响结直肠癌发生的因素之一。
在细胞实验中,通过蛋白质体外结合实验发现,P. stomatis可通过果糖-1,6-二磷酸醛缩酶(FBA)蛋白与CRC细胞整合素a6/b4结合,附着和侵袭CRC细胞,减弱线粒体凋亡途径,通过GS-1诱导细胞增殖,从而引起致癌通路ERBB2-MEK-ERK-p90的异常激活。
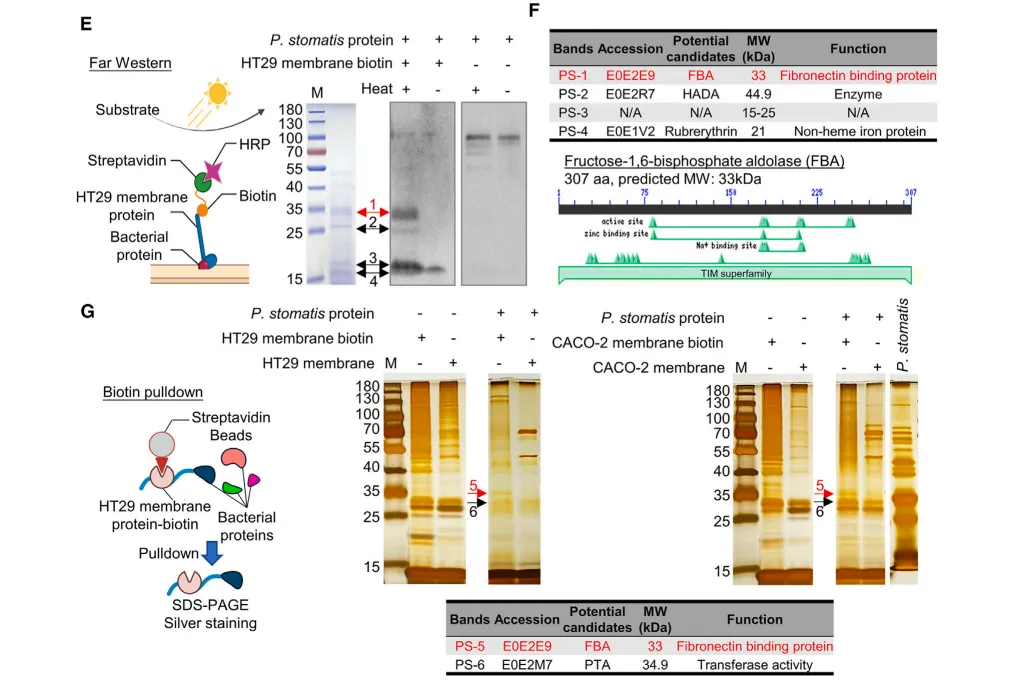
接下来,作者进一步阐明fba-整合素α6/β4相互作用所导致的信号传导机制。ApcMin/+小鼠灌胃P. stomatis后,α6/β4被激活,导致了ERBB2的表达和磷酸化。P. stomatis在体内外增加了p-c-RAF、p-MEK、p-ERK和p-p90RSK的表达,而这些作用会被ERBB2敲低所消除。值得注意的是,使用siRNA或中和抗体抑制整合素α6/β4后,其介导的ERBB2及其下游MAPK信号的激活也被减弱,因此作者推断P. stomatis介导的fba-整合素6/b4-ERBB2-MAPK轴在肿瘤发展中发挥了作用。
过往的研究表明ERBB2的激活会导致结直肠癌中肿瘤的发展并对EGFR抑制剂的产生耐药性,而P. stomatis激活了ERBB2和下游的MAPK信号通路,因此作者推测P. stomatis可能会对酪氨酸激酶抑制剂在结直肠癌中的疗效产生不利影响。
在细胞实验中,P. stomatis增加了p-ERBB2和ERBB2蛋白的表达,导致西妥昔单抗和维莫非尼处理的CACO-2和HT29中p-c-RAF、p-MEK、p-ERK和p-p90RSK的重新激活,使得ERBB2绕过了受体酪氨酸激酶(RTKs)抑制剂对MAPK信号的阻断,从而导致CRC细胞系对靶向治疗的耐药性。
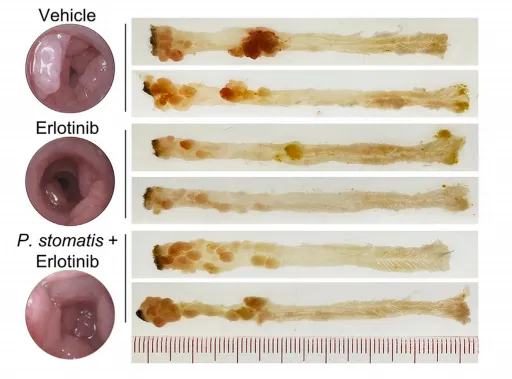
P. stomatis在AOM-DSS诱导的结直肠癌模型中消除了厄洛替尼的抗肿瘤作用,同时增加了细胞增殖、抑制了细胞凋亡。使用西妥昔单抗或帕尼单抗治疗的CRC患者中,与P. stomatis 阴性患者相比,P. stomatis 阳性患者表现出生存率较差的趋势,这也验证了P. stomatis会使得KRAS野生型或BRAF突变型结直肠癌患者发生耐药。
总体看来,该研究表明,P. stomatis是通过ERBB2激活的旁路机制促进CRC中RTK抑制剂耐药的一个因素。该研究找到了结直肠癌中一种重要的致癌病原体,为后期临床干预提供了潜在的干预靶点。而PD1耐药模型作为研究免疫治疗耐药性的重要工具,对于推进免疫治疗的发展和个性化治疗策略的制定具有深远的意义。

