肠道菌群新发现:C. symbiosum促进结直肠癌发展的机制揭秘
2024年8月5日,上海交通大学医学院附属仁济医院房静远教授团队在知名学术期刊《细胞·宿主与微生物》(Cell Host & Microbe,影响因子20.6)上发表了一项重要研究成果,题为“BCAA-producing Clostridium symbiosum Promotes Colorectal Tumorigenesis Through the Modulation of Host Cholesterol Metabolism”。研究指出,一种可以产生支链氨基酸(BCAA)的共生梭菌Clostridium symbiosum(C. symbiosum)能够通过调节宿主胆固醇代谢,促进结直肠癌的发生。这一发现为理解结直肠癌的发病机理提供了新的视角,并揭示了特定细菌种类在肿瘤发生中的潜在作用。该研究使用了来自集萃药康的ApcMin/+小鼠(C57BL/6JGpt-Apcem1Cin(Min)/Gpt,T001457)。

研究者们发现,C.symbiosum可以通过厌氧发酵产生大量的BCAA(包括缬氨酸、亮氨酸和异亮氨酸)。这些BCAA在肠道中被吸收后,能够显著增强宿主细胞的胆固醇合成能力。BCAA通过激活哺乳动物雷帕霉素靶蛋白(mTORC1)信号通路,上调胆固醇合成关键酶(如HMG-CoA还原酶HMGCR)的表达,从而促进细胞内胆固醇的积累。胆固醇的积累进一步激活了Hedgehog信号通路,维持了结直肠癌干细胞的自我更新和增殖能力,促进了肿瘤的发展。
这项研究不仅揭示了C. symbiosum在结直肠癌发生发展中的作用机制,还为结直肠癌的预防和治疗提供了新的靶点。通过调控肠道菌群或抑制BCAA代谢,有望降低结直肠癌的风险或延缓其进展。
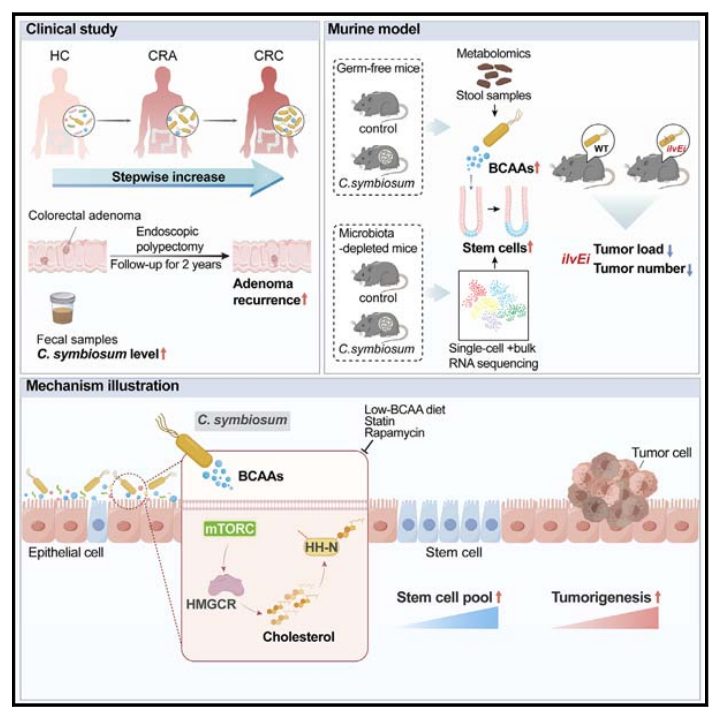
为了研究C. symbiosum对小鼠结肠直肠癌发生的潜在影响,研究者们建立了3种细菌敲除小鼠模型,即结肠炎相关癌(CAC)模型、基于偶氮甲烷(AOM)的散发性肿瘤模型和ApcMin/+小鼠模型。
在ApcMin/+小鼠模型的研究中,研究者们发现特定微生物C. symbiosum的引入显著促进了小鼠结肠肿瘤的形成,表现为肿瘤数量和负荷的显著增加。组织学分析进一步揭示了C. symbiosum处理组小鼠肠道肿瘤的高级别异型性,以及肿瘤区域和正常上皮中细胞增殖标志物Ki67的高表达,这有力地证明了C. symbiosum对结直肠癌发生发展的促进作用。
当研究者们通过引入低BCAA(支链氨基酸)饮食时,发现其能在一定程度上抑制肿瘤负荷。然而,当给这些小鼠灌胃C. symbiosum细菌时,这种抑瘤效果被部分恢复,且热灭活的C. symbiosum未产生类似效应。进一步,利用CRISPR-Cas12a系统构建了干扰ilvE基因(BCAA合成关键酶)的C. symbiosum(ilvEi),发现其BCAA生产能力显著降低,同时在不影响细菌生长的情况下,显著抑制了其在微生物群剥夺的ApcMin/+小鼠中的促肿瘤作用。此外,雷帕霉素对mTORC1的抑制显著抑制了ApcMin/+小鼠中C.共生菌的致瘤作用。这表明C. symbiosum在临床上与粪便BCAA水平相关,可能通过产生BCAAs促进肿瘤生长。
Apc-Min突变小鼠是集萃药康一款自发肿瘤小鼠模型,采用基因编辑技术制作。高脂饮食条件下,雄性和雌性杂合小鼠有明显的肠道腺瘤且数量较多,多见于回肠和空肠。因此,Apc-Min 小鼠模型是理想的肠道肿瘤模型,广泛应用于癌症研究(消化道肿瘤、腺瘤)及抗肠道肿瘤小分子药物筛选等领域。

