捷报:集萃药康自主产权Trex1 KO小鼠助力探究cGAS介导的I型干扰素病新机制!
2024年6月,山东大学基础医学院高成江教授团队在国际著名期刊Cell Reports上发表了题为“Stress granule-localized USP8 potentiates cGAS-mediated type I interferonopathies through deubiquitination of DDX3X”的研究论文,研究揭示了无膜细胞器应激颗粒调控cGAS相分离及I型干扰素疾病的新机制,该研究使用了来自集萃药康自主产权的Trex1 KO小鼠(Strain NO. T013987)。

Ⅰ型干扰素病是一种由Ⅰ型干扰素过度产生导致的自身免疫性疾病,会引起紊乱性炎症以及组织损伤。多种类型的Ⅰ型干扰素病是由于内源性核酸的异常积累,与病毒DNA相似,线粒体、细胞核泄漏或降解失败会导致细胞质中的异常dsDNA会被环GMP-AMP合成酶(cGAS)识别。这种识别会引发cGAS的激活,产生第二信使环 GMP-AMP (cGAMP),并激活下游适配蛋白干扰素基因刺激器 (STING),最终导致I型干扰素和促炎细胞因子的产生。鉴于cGAS-STING 信号在自身免疫性疾病中的重要作用,对其进行严格调控对于维持细胞免疫平衡至关重要。因此,以cGAS-STING信号为靶点是治疗相关自身免疫性疾病的一种具有广阔前景的策略。
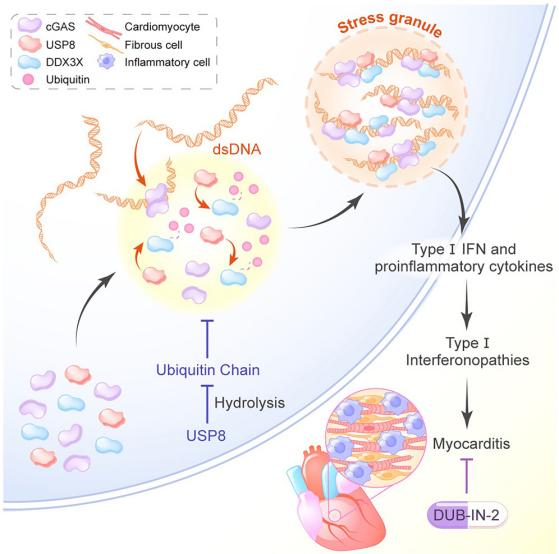
图1:文章总结图
在本项研究中,研究人员首先筛选了在dsDNA刺激下的定位于应激颗粒的去泛素化酶,进而在巨噬细胞敲低或敲除定位于应激颗粒的去泛素化酶,发现USP8敲低或敲除可显著减少dsDNA诱导的I型干扰素和炎性细胞因子的产生,此结果提示USP8对cGAS-STING信号通路活化至关重要。那么,USP8又是如何调控cGAS-STING信号通路呢?研究团队通过体内和体外实验发现,USP8可以促进cGAS凝聚体的形成。一方面USP8通过促进DDX3X固有无序结构域(IDR)的K27连接的泛素链的去泛素化,增强DDX3X的相分离能力;另一方面DDX3X与cGAS结合促进cGAS凝聚体形成及活化,对cGAS的促进功能依赖于其自身相分离能力。
Trex1是一种DNase,负责降解细胞质中的DNA。TREX1 缺乏会导致DNA的积累,而DNA的积累会不断刺激 cGAS-STING 通路,cGAS-STING 通路的过度激活进而又会引发患者的自身免疫性疾病。那么USP8能否改善细胞中过量DNA引发的自身免疫反应呢?
在体内实验中,自身免疫性疾病模型Trex1 KO小鼠的心脏、脾脏出现肿大,血清中炎性细胞因子IL-6、TNF-α、ALT和AST升高,肝脏、心脏出现病理炎症。这些系统性全身炎症主要源于cGAS的活化。本研究发现使用USP8酶活特异性抑制剂DUB-IN-2,可有效改善Trex1缺失小鼠的病理炎症和自身免疫表型。系统性红斑狼疮(SLE)数据库显示USP8与SLE发病正向相关,使用DUB-IN-2可缓解SLE病人PBMC细胞分泌的炎性因子。
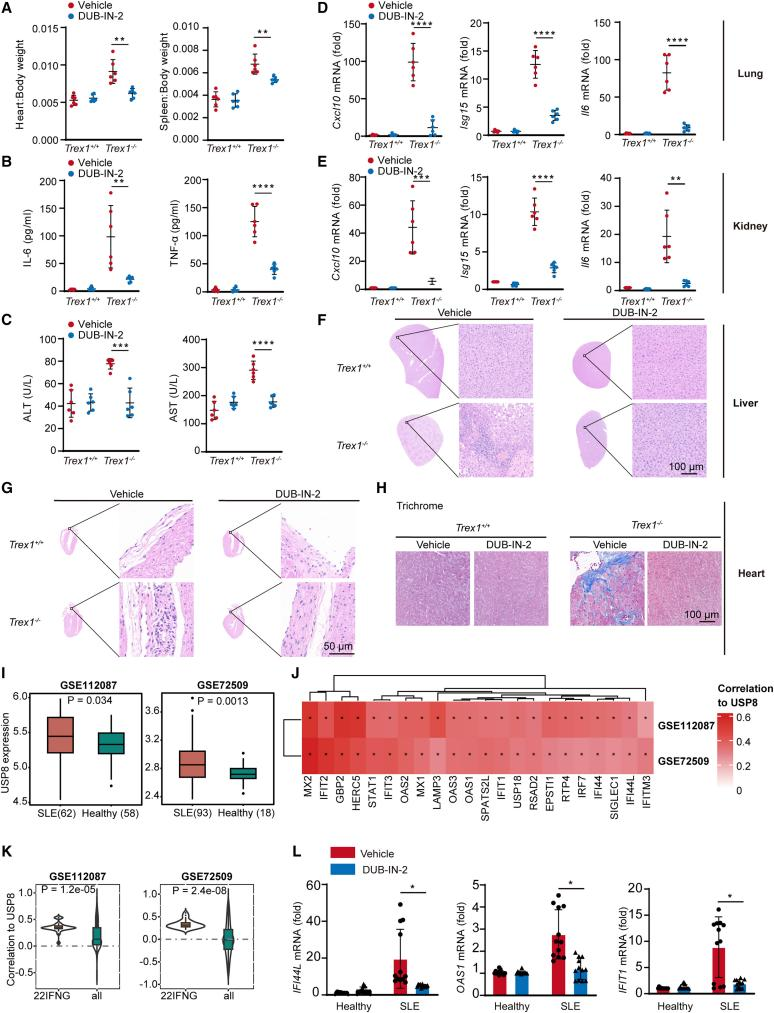
图2:Inhibition of USP8 ameliorates cGAS-mediated autoimmune diseases
本研究首次揭示USP8定位于应激颗粒并调控DDX3X泛素化促进其相分离,进一步促进cGAS-STING信号通路活化。同时,本研究发现靶向USP8的小分子抑制剂DUB-IN-2通过干扰cGAS的激活缓解Trex1 KO小鼠模型的自身免疫炎症反应。因此,开发安全有效的USP8抑制剂可能成为治疗I型干扰素疾病的新药物。
以上引用内容,均已得到第一作者许可
集萃药康自免平台主要聚焦系统性红斑狼疮、炎性肠病、多发性硬化症、银屑病、特应性皮炎、类风湿性关节炎、免疫性肾病等多种疾病领域,可提供动物模型和技术服务,并可定制药物开发非临床一站式服务。