Cell 重磅!肿瘤微环境氨代谢新机制:Treg 细胞介导免疫治疗抵抗的破解思路
肿瘤微环境(TME)代谢产物对免疫细胞功能的调控,是当前肿瘤免疫学研究的核心方向。近期,徐州医科大学吕凌教授、南京医科大学第一附属医院古鉴教授团队的研究成果,以 “Tumor-produced ammonia is metabolized by regulatory T cells to further impede anti-tumor immunity” 为题发表于《Cell》,揭示了 Treg 细胞利用肿瘤产生的氨增强免疫抑制功能的新机制,为克服免疫治疗抵抗提供了全新靶点。

图1. 文献来源
一、实验设计:多维度验证氨代谢通路
(一)临床样本空间多组学分析
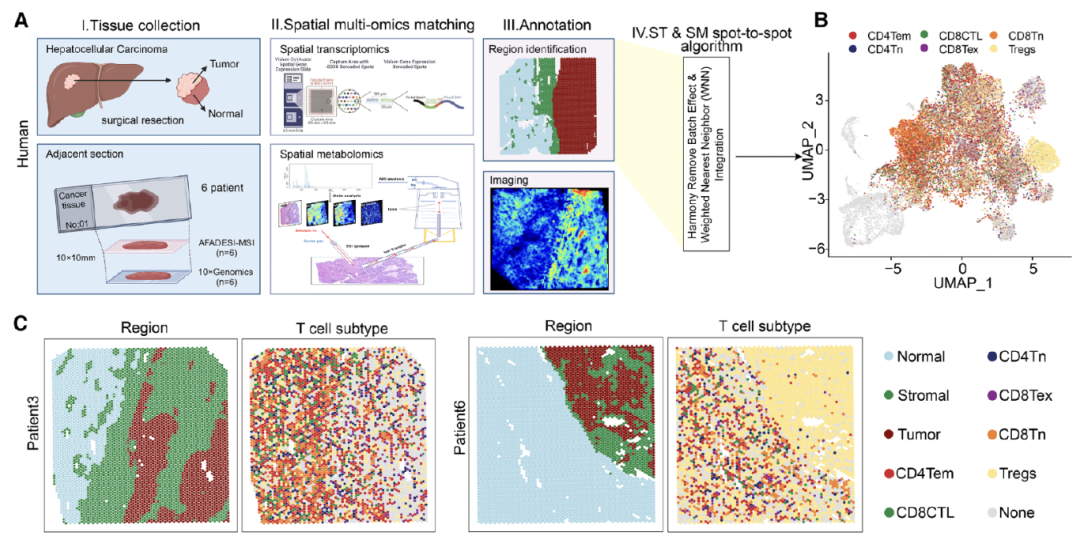
1. 研究团队收集 6 例 HCC 患者组织样本,制备冷冻切片;
2. 采用 Visium CytAssist 平台进行空间基因表达分析,相邻切片同步开展 AFADESI-MSI 分析;
3. 通过 UMAP 降维聚类,成功鉴定免疫细胞富集区域,发现 Treg 细胞在肿瘤组织内分布范围显著更广。
(二)小鼠模型多层次验证体系
1. 基础肿瘤模型:建立 C57BL/6 小鼠原位肝癌模型(Hep-53.4 细胞系),在注射后 1、2、3 周收集肿瘤组织进行空间代谢组学分析及 Treg 免疫组化染色;
2. 基因工程小鼠模型:使用 Asl fl/fl Foxp3YFP-Cre(Treg 特异性 ASL 敲除)、Ppary fl/fl Foxp3YFP-Cre(Treg 特异性 PPARγ 敲除)、PparyMut Foxp3YFP-Cre(点突变)及 Rag1-KO 模型,用于机制验证;
3. 多肿瘤类型覆盖:包含皮下移植瘤模型(Hep-53.4、MC38、B16-F10、Lewis 等细胞系)、尾静脉注射诱导 HCC 模型(HTVI-HCC)、代谢功能障碍相关脂肪性肝炎 - HCC 模型(MASH-HCC)。
二、核心研究结果:氨代谢双通路增强 Treg 免疫抑制功能
(一)氨诱导 Treg 细胞尿素循环激活
1. 与 CD8+、CD4+ T 细胞相比,Treg 细胞在富氨环境中尿素循环活性更强;
2. 15N 标记追踪证实,Treg 通过 SRC3 介导的 STAT3 激活,上调精氨基琥珀酸裂解酶(ASL)表达,将氨转化为尿素循环中间产物,解除氨毒性;
3. 结构模拟与 SPR 分析显示,氨可增强 SRC3-STAT3 结合亲和力。
图2. 肿瘤亚区富含 Treg 细胞,其关键代谢特征是谷氨酰胺分解活性高而尿素循环活性低
(二)FOXP3 驱动精胺合成,提升 Treg 氧化磷酸化水平
1. 氨在 FOXP3 转录因子调控下,经精胺合成酶(SMS)转化为精胺;
2. X 射线晶体学分析表明,精胺与 PPARγ 直接相互作用,调控线粒体呼吸链复合体蛋白转录;
3. 最终提升 Treg 细胞氧化磷酸化水平,增强其免疫抑制功能。
(三)抗 PD-1 治疗诱导氨产生,加剧治疗抵抗
1. 临床样本显示,接受抗 PD-1 治疗的 HCC 患者,肿瘤组织氨水平与 Treg 浸润均升高;
2. 机制上,抗 PD-1 诱导肿瘤细胞死亡,通过转氨反应释放氨,强化 Treg 功能导致耐药;
3. 动物实验证实,GLUD 抑制剂 R162 与抗 PD-1 联合治疗,可降低肿瘤内氨水平、减少 Treg 积累、增强 CD8+ T 细胞功能,破解耐药问题。
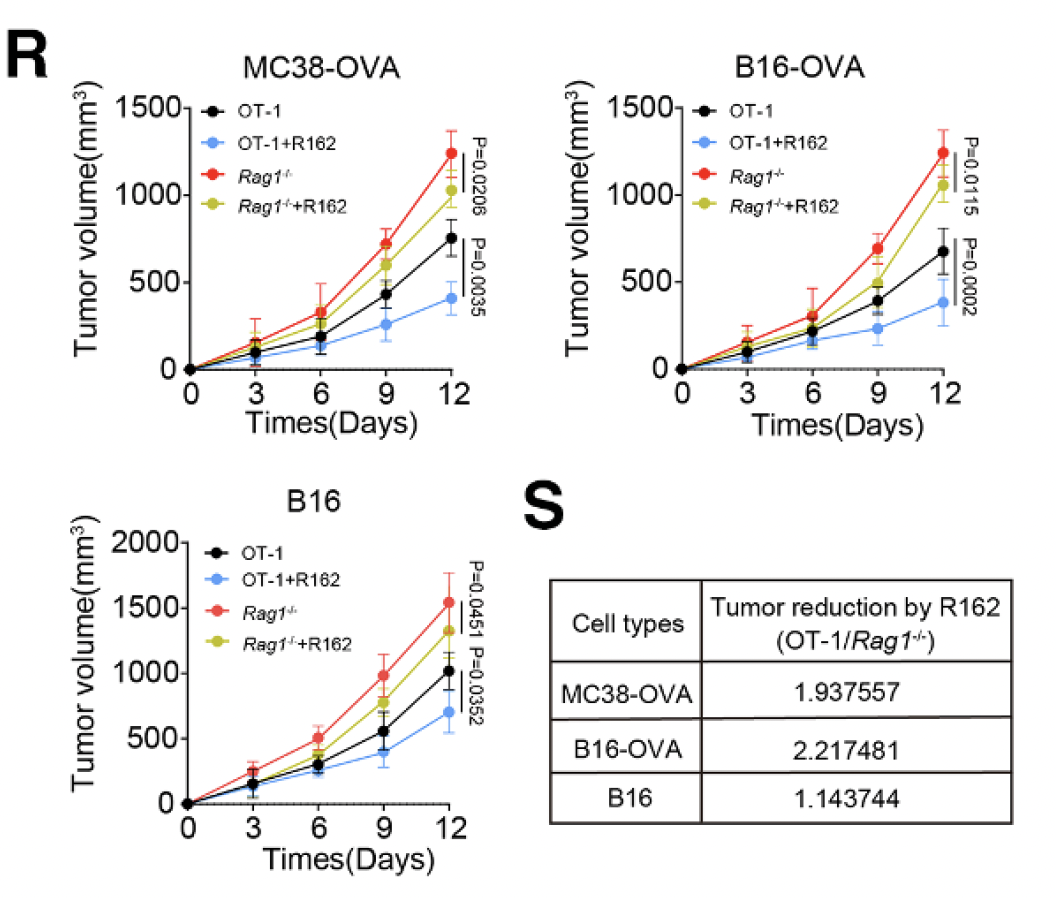
图3. GLUD1抑制剂R162的药效数据
三、研究意义与转化前景
1. 机制创新:首次揭示 Treg 细胞通过 “SRC3/STAT3-ASL 尿素循环” 和 “SMS - 精胺 - PPARγ” 双通路适应氨应激,为理解肿瘤免疫逃逸提供全新视角;
2. 治疗价值:明确氨代谢通路为潜在干预靶点,GLUD1 抑制剂与抗 PD-1 联合治疗方案,有望突破免疫治疗抵抗,具有良好转化前景;
3. 研究支撑:精准的动物模型是本研究顺利推进的关键,所用 Asl (fl/fl) Foxp3 (YFP-Cre)、Ppary (Mut) Foxp3 (YFP-Cre)、Rag1-KO 等模型均由药康生物提供。
四、药康生物模型支持与服务
药康生物作为国内领先的小鼠模型供应商,提供全面的实验动物模型资源与定制服务:
1. 模型类型覆盖:基因敲除小鼠、工具鼠、免疫系统人源化小鼠、肿瘤模型小鼠、代谢疾病模型等;
2. 核心服务方向:支持创新药物研发中的药效评价、机制研究,提供特异性基因敲除模型、肿瘤移植模型等定制服务;
3. 使命定位:以优质模型动物与技术支持,助力科研人员推动生命科学探索与创新药物研发进程。