小鼠基因型鉴定标准化实操指南
小鼠基因型鉴定是基因工程小鼠相关研究的核心基础环节,直接影响实验分组准确性与研究数据可靠性。科研人员在实操中常面临条带异常、判读误差、扩增失败等问题,如纯合子结果呈现杂合子特征等。本文严格基于实验实操经验,梳理鉴定核心流程与关键要点,为科研人员提供标准化参考。
一、PCR 基本原理与核心要素
小鼠基因型鉴定以 PCR 技术为核心,通过模拟 DNA 天然复制过程,经变性、退火、延伸三步循环实现目标基因片段的特异性扩增。成功完成鉴定需把控四大关键要素:
1. 高质量 DNA 模板:无污染、无降解,为扩增提供稳定基础;
2. 特异性引物:精准匹配目标基因序列,减少非特异性结合;
3. 适配的 PCR 程序:温度与循环参数匹配引物及片段特性;
4. 高效扩增酶:保障 DNA 链合成的稳定性与扩增效率。
二、DNA 模板质量控制规范
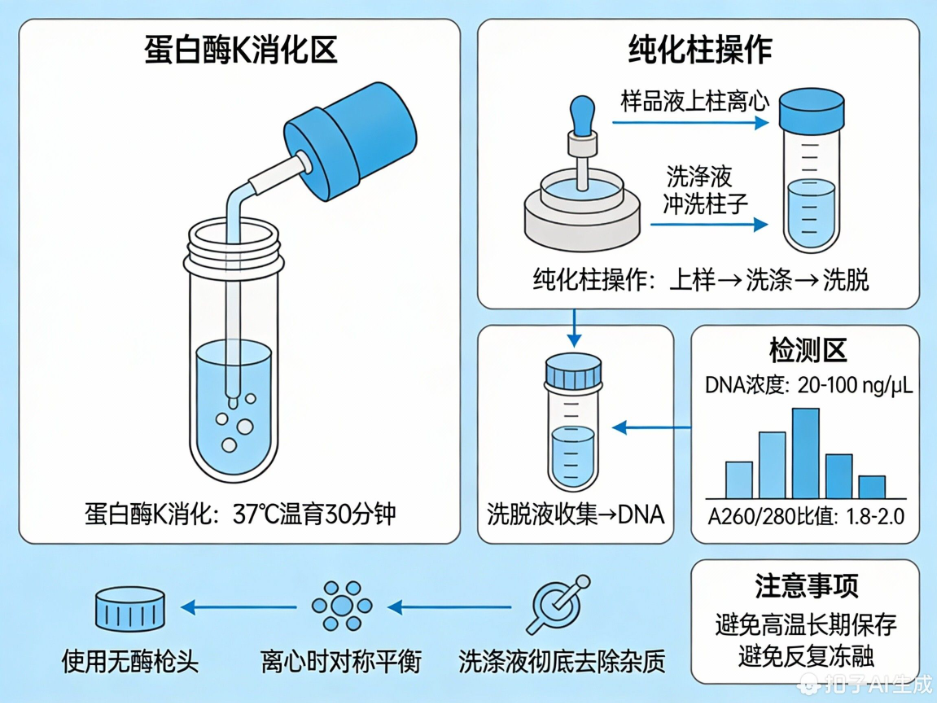
DNA 模板的纯度与完整性直接决定扩增效果,推荐采用 “蛋白酶 K 消化 + 纯化柱法” 制备,核心要求如下:
1. 消化流程:37℃温育 30 分钟,确保组织样本充分消化;
2. 纯化步骤:严格执行 “上样→洗涤→洗脱” 流程,彻底去除蛋白质、有机溶剂及盐类杂质;
3. 质量标准:DNA 浓度控制在 20-100 ng/μL,A260/280 比值需在 1.8-2.0 之间;
4. 保存与操作:避免高温长期存放及反复冻融,防止 DNA 降解;离心时需对称平衡,全程使用无酶枪头,规避交叉污染。
三、引物设计与优化策略
1. 设计核心:针对目标基因片段精准设计,规避非特异性结合位点;
2. 问题应对:同一模板中部分基因扩增异常时,优先重新设计引物,同步核查并提升模板质量;
3. 温度适配:引物特异性与退火温度密切相关,需根据实际情况优化调整。
四、PCR 程序设置要点
1. 常规程序:采用变性 - 退火 - 延伸三步法,依据引物特性与片段长度设定各步骤时长;
2. 特异性优化:针对复杂片段可采用梯度降温程序(Touch down, TD),前 20 个循环中退火温度从 65℃每循环递减 0.5℃至 55℃,通过较高温度优先富集目的产物,减少非特异性扩增。
五、扩增酶选择原则
优先选用组分简单、扩增效率高、批次稳定性强的 DNA 聚合酶。避免使用辅助成分过多的酶制剂,防止其与模板中微量杂质发生相互作用,影响扩增效果。
六、常见问题与解决方案
实验过程中常会遇到多种问题:泳道弥散可能源于凝胶浓度不当;空白对照出现目的带提示存在污染;即使加倍DNA模板仍无扩增时,需系统检查引物设计、程序参数和酶活性等因素。这些问题都需要通过方法优化和严格的操作规范来解决。
小编特意为大家准备了一份《小鼠基因型鉴定说明书》,扫描下方二维码可进行下载~


