攻克小鼠尾静脉注射!3步精讲,小白变高手
尾静脉注射是动物实验中的一项关键技术,因其给药精准可靠,被广泛应用于药代动力学和全身性疾病模型(如肿瘤转移、感染)研究。然而,较高的操作门槛常让科研新手感到难以掌握。本文将系统拆解尾静脉注射的核心流程与实用技巧,涵盖从准备、固定、血管定位到注射及特殊情况的处理,助您掌握这项不可或缺的实验技能。
核心流程详解
1. 周密准备:成功的起点
• 基础器材:确保备齐1ml注射器(推荐使用4.5号针头)、75%酒精棉球和小鼠专用固定器(图1)。注射器吸入药液后,必须彻底排尽内部空气,这是防止空气栓塞导致小鼠急性死亡的关键步骤。
• 稳固固定(核心环节):限制小鼠活动是操作成功的基石。强烈推荐使用小鼠固定器(图2)。其前端设计有气孔保证呼吸通畅,后端可拉出鼠尾进行注射。使用时需确保小鼠在固定器内活动空间极小,有效防止注射过程中的挣扎。

图1

图2
2. 精准定位与血管扩张:看清目标
• 认识目标血管:小鼠尾部静脉系统由三条主要静脉组成:一条位于背侧(较深且细),两条位于左右两侧(较浅表)。此外,腹侧有一条动脉(图3)。通常优先选择左右两侧的尾静脉进行注射,因其位置更浅、更易操作。

图3
让血管清晰可见: 小鼠尾静脉非常纤细,直接注射难度大。操作前可以采取以下方法扩张血管:
• 温水浸泡法:将鼠尾末端浸入45-50℃的温水中约2分钟,有效促进血管扩张。
• 酒精擦拭法:用酒精棉球反复、适当地用力擦拭目标血管区域(图4)。酒精既能扩张血管,又能软化尾部的表皮角质层,显著降低进针阻力。
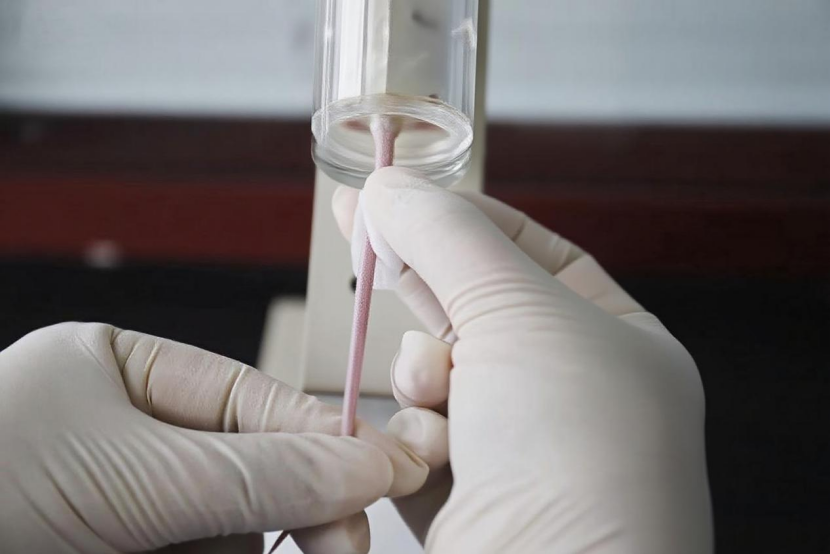
图4
• 红外灯照射法: 使用红外线烤灯照射鼠尾3-5分钟,利用热能刺激使静脉充分充盈,尤其适用于血管不易观察的品系。
3. 注射操作:核心技巧与手感判断
• 起始进针点:左手拇指在上,食指在下,捏住小鼠尾巴末端1/3处,转动尾巴使一侧静脉血管显现,食指上提,拇指下压使尾巴弯曲,尾巴转折点在拇指上方,下针位置即在尾巴的转折点处(图5)。此处皮肤相对较薄,血管在扩张后相对清晰,且为后续可能的失败尝试留出了向近心端移动的空间。

图5
• 进针角度与手法: 针头与静脉尽量平行(10至15度)(图6),注射器针头斜口朝上慢慢扎入血管,一旦感觉针尖有轻微的“刺空感”(针头斜口约2/3 插入血管)后,针头略微往上挑将整个针头斜口全部进入血管,然后保持平行于血管走向再稍微推进少许,确保针尖完全进入血管腔。

图6
• 成功注射的关键标志:
○ 回血现象:针头刺入静脉后,通常可在针管透明接口处观察到少量血液自然回流,这是判断针尖位于血管内的直接证据(需清晰观察)。
○ 无阻力推注:推注药液时手感必须极其顺畅,几乎感觉不到阻力。这是判断针尖是否在血管内的核心手感。
○ 血管内流动显影:在药液推入过程中,可清晰观察到血管由淡紫色转为不可见(图7)。
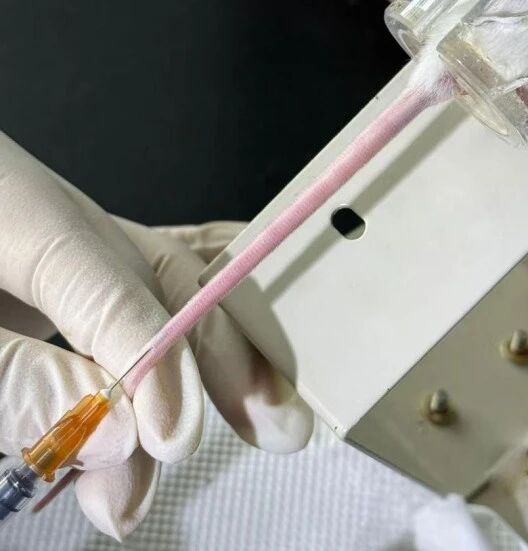
图7
○ 拔针与有效止血:注射完成后,缓慢旋转针头将其退出血管。迅速用干燥棉球或纱布适度用力、持续按压注射点,直至确认完全止血(图8)。此步骤对保护血管完整性、减少淤血、为后续可能的注射创造条件至关重要。
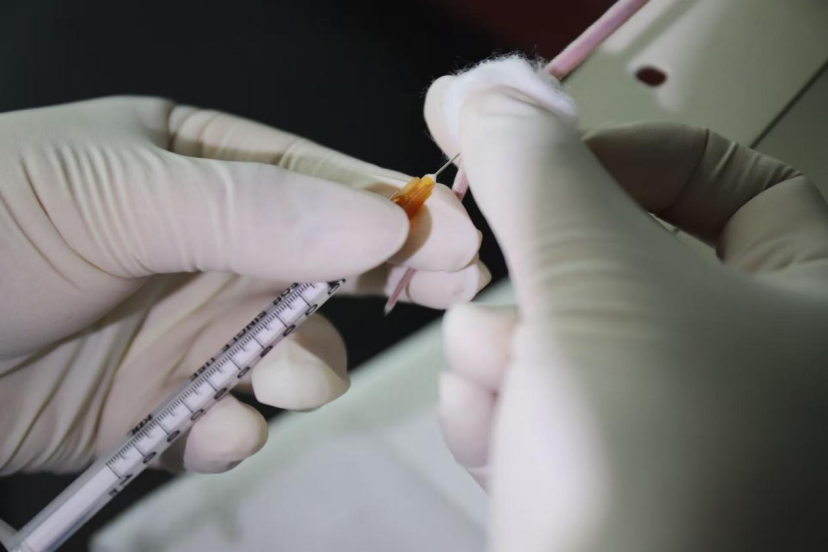
图8
• 失败征兆与应对:
○ 推注阻力巨大:手感明显阻塞,难以推动药液。——针头未进入血管
○ 组织肿胀变白:药液未能进入血管而渗入皮下组织,导致局部皮肤变白、鼓起或形成皮丘。——针头未进入血管
○ 拔针后大量渗出:针孔处有血液和/或药液持续渗出。——针头未进入血管或进入血管较浅
○ 尾部淤血肿胀:操作失败后,尾部可能出现明显的暗紫色淤血区域及整体肿胀。——针头未进入血管/注射时可能由于多次操作损伤周围组织/药液刺激性过大
○ 应对策略:一旦感知阻力或出现上述现象,立即停止推注,退针后,充分按压止血。随后选择更靠近尾根(近心端)的新位置重新尝试注射。
4. 不同品系小鼠的操作差异
• 裸鼠:裸鼠的静脉血管虽然呈扁平状且相对细小,但由于其无毛且皮肤近乎透明,血管的可见度是最高的,操作相对最为容易。按照前述标准流程操作即可。
• 白化小鼠(如ICR, BALB/c):白鼠的血管在酒精充分擦拭后通常比较清晰可见,操作难度中等。注意扩张血管和进针技巧。
• 黑色/深色皮毛小鼠(如C57BL/6):黑鼠的血管最难辨别,是操作的主要难点。必须更加依赖血管扩张技巧(强烈推荐红外灯照射与酒精擦拭结合使用),并需要更仔细地观察。此外,深色品系鼠尾皮肤有时更坚韧,进针需施加稍大力气,但务必避免刺入过深。
5. 特殊注射物的注意事项(细胞、病毒、细菌悬液)
尾静脉注射不仅用于给药,也广泛用于建立疾病模型,如通过注射肿瘤细胞建立转移模型、注射病毒载体进行基因操作或感染研究、注射细菌建立菌血症模型等。处理这类悬液时,除遵循前述通用技巧外,需特别注意以下关键点:
• 悬液均匀性与浓度:细胞、病毒或细菌悬液在吸入注射器前,必须充分混匀、确保悬液颜色均匀、无肉眼可见的团块或沉淀。这类悬液通常比普通药液更粘稠。
• 严格控制注射速度:推注速度不能过快,且需要匀速平稳推注! 过快的注射速度(尤其是细胞悬液)极易导致急性肺栓塞、心血管休克甚至小鼠急性死亡。注射过程中需密切观察小鼠的呼吸、活动状态等生命体征。
• 术后保温与监护:注射大量细胞或病原体后,小鼠常出现体温下降、虚弱甚至休克。若出现此类情况时,注射后应立即将小鼠转移到恒温垫或暖台上,持续监护直至其完全恢复活动能力和正常体温。
• 严格的生物安全防护:操作此类物质时,务必全程佩戴手套、口罩及护目镜。强烈建议在生物安全柜内进行注射操作,最大程度防止悬液溅洒造成实验人员感染或环境污染。使用过的注射器、接触物及动物废弃物必须严格按照生物危害物处理规范进行处置。
6. SD大鼠的尾静脉注射要点
大鼠尾静脉注射的基本原理和操作步骤与小鼠类似,但需额外注意两点:
• 更强的固定需求:大鼠力量更大,挣扎更剧烈。必须使用专用大鼠固定器或采取非常稳固的徒手/辅助固定方式,确保其身体和尾部在注射过程中几乎无法移动。
• 更充分的血管暴露:大鼠尾部角质层通常更厚。需要更长时间(或更高温度)的温水浸泡或酒精更大力度地反复擦拭,以充分扩张和清晰显现尾静脉。
精进之道:理解、细节与练习
掌握尾静脉注射的精髓在于透彻理解尾静脉的解剖位置与特点,精准把握操作的核心细节(如进针点选择、平行进针、上挑角度、无阻力手感),并通过反复、规范的练习来培养稳定的操作手感和遇到问题时的判断力。
尾静脉注射虽具挑战性,但它是连接实验设计与科学发现的重要桥梁。熟练掌握此项技术,能极大提升实验效率和模型成功率。通过理解原理、关注细节、勤加练习并参考本文提供的图解指南,每一位科研工作者都能攻克这一技术难关。请务必保持耐心细致,科学探索之路亦在于此~

