Cell丨高彩霞团队解锁染色体“分子手术刀”:可编程PCE系统实现兆碱基级精准编辑
在生命科学领域,基因组编辑技术已成为推动基础研究和应用开发的革命性工具。以CRISPR系统为代表的方法,通过可编程RNA引导核酸酶靶向特定基因位点,实现了单碱基或短片段DNA的高效修改。然而,对于数千至数百万碱基的大片段DNA操纵,现有工具在效率、精准度和多样性方面存在显著局限。这种瓶颈限制了基因关键区域的替换、功能序列的完整插入、基因簇删减或重定位等操作,阻碍了疾病治疗、作物改良和合成生物学的发展。理想的大片段编辑工具应支持染色体水平的多种编辑类型,包括插入、替换、删除、倒位和易位,但现有技术难以满足这些需求。
2025年8月4日,中国科学院遗传与发育生物学研究所高彩霞团队在《Cell》杂志上发表了题为“Iterative recombinase technologies for efficient and precise genome engineering across kilobase to megabase scales”的研究。该工作系统报道了一种名为可编程染色体工程(PCE)的新型编辑系统,首次在动植物中实现了从千碱基(kb)到兆碱基(Mb)级别的精准无痕编辑,大幅提升了基因组操纵能力。研究团队针对位点特异性重组酶Cre-Lox系统的固有缺陷进行了优化:该系统虽具染色体操纵潜力,却受限于可逆性重组反应、多聚化酶活性不足及编辑后残留位点等问题。

为突破这些限制,团队开发了三大核心技术。首先,通过高通量重组位点改造平台,设计了不对称Lox变体位点,成功将可逆性重组活性降至接近阴性水平,同时保留高效正向重组能力。其次,利用团队自主研发的AiCE蛋白工程平台(该成果已于7月7日发表于Cell),优化了Cre酶的多聚化界面,创制出重组效率提升3.5倍的工程化变体。最后,创新性地结合引导编辑技术,开发了Re-pegRNA无痕编辑策略,能精准去除重组后残留的Lox位点,恢复原始基因组序列。这三项技术的集成优化,构成了PCE和RePCE两套可编程系统,支持对不同Lox位点位置和方向进行灵活设计,实现大尺度DNA的无痕操纵。
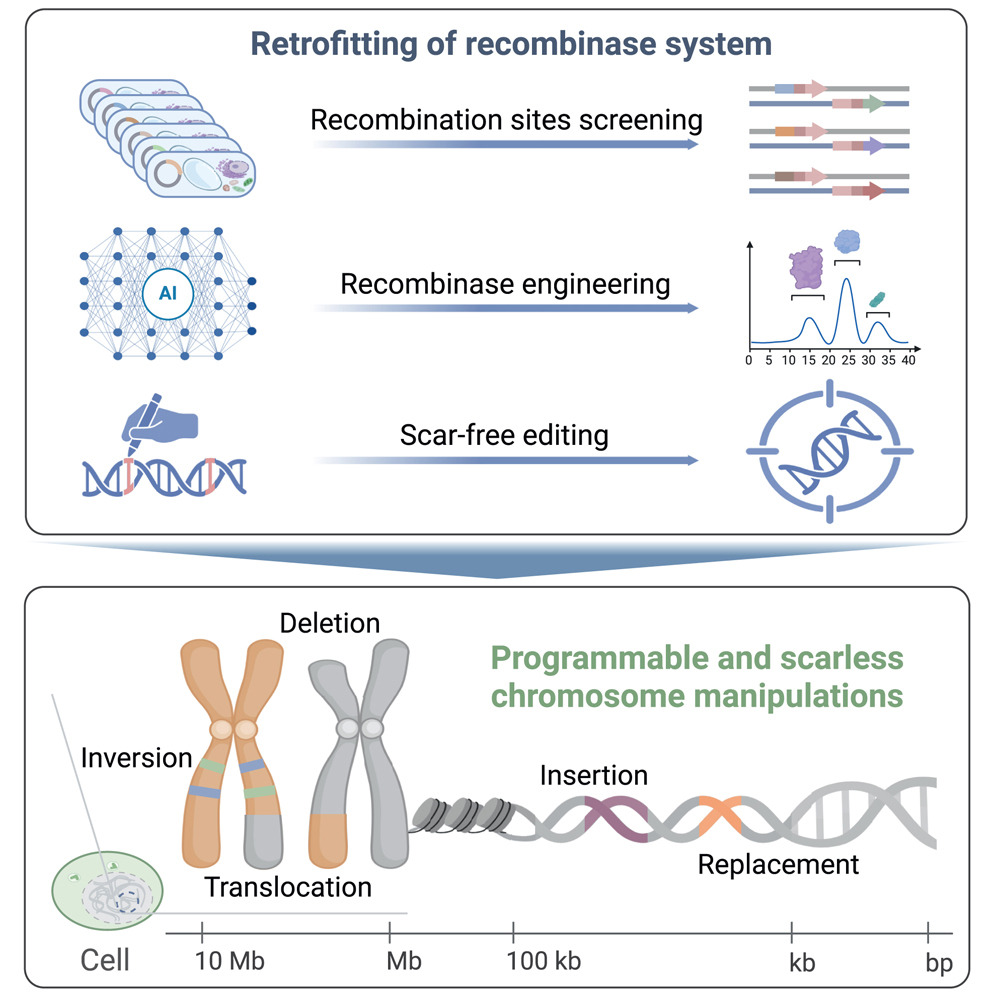
基于PCE的染色体编辑系统开发全解析
在实验验证中,PCE系统在动植物细胞中展示了卓越性能。例如,它实现了18.8kb DNA片段的定点整合、5kb序列的定向替换、12Mb染色体的倒位、4Mb区域的删除以及整条染色体的易位。这些操作跨越了kb至Mb尺度,突破了真核生物基因组编辑的尺度限制。尤其值得注意的是,团队利用该技术创制了含315kb精准倒位的抗除草剂水稻种质,证明了其在作物改良中的实用价值。审稿人评价该工作“代表了基因工程领域的重大突破”,为育种和基因治疗开辟了新路径。
PCE系统的应用前景广阔。在农业领域,它能通过操纵遗传连锁和调控重组频率,实现育性控制或消除连锁累赘,释放野生种质资源的育种潜力。在医学上,该技术为遗传疾病治疗提供了新工具,例如修复大型基因缺陷或构建人工结构变异。此外,它还将加速合成生物学的发展,推动人工染色体构建。未来,PCE有望革新传统育种策略,并为新兴领域如基因组结构变异研究提供支撑。
参考文献
https://doi.org/10.1016/j.cell.2025.07.011

