加速小核酸药物上市!这些动物模型功不可没
传统上,小核酸药物主要用于罕见病治疗。然而,随着技术进步,其应用范围已拓展至慢性疾病领域,市场持续扩大,成为当前药物研发的热点。以诺华/Alnylam联合开发的Inclisiran(英克司兰钠)为例,这款靶向PCSK9的siRNA药物,作为一种长效降脂疗法,仅需每半年注射一次。自2020年起,该药物相继在欧盟、美国和中国获批上市。2024年,Inclisiran销售额飙升至7.54亿美元(约合55.09亿人民币),同比暴涨114%,预计2025年将成为年销售额突破10亿美元的重磅炸弹药物[1]。
小核酸药物的概念可追溯至1978年反义寡核苷酸(ASO)的提出,经历了长达20年的艰难探索。由于早期存在稳定性差、副作用大等关键问题难以克服,该领域曾陷入长期低迷,众多企业纷纷退出。低谷期,Ionis等公司坚持技术攻坚。2013年,Ionis的第二款药物Mipomersen成功上市,成为行业复苏的关键转折点。此后,大批制药企业重返或新进入该领域,推动小核酸药物行业迈入快速发展新阶段。
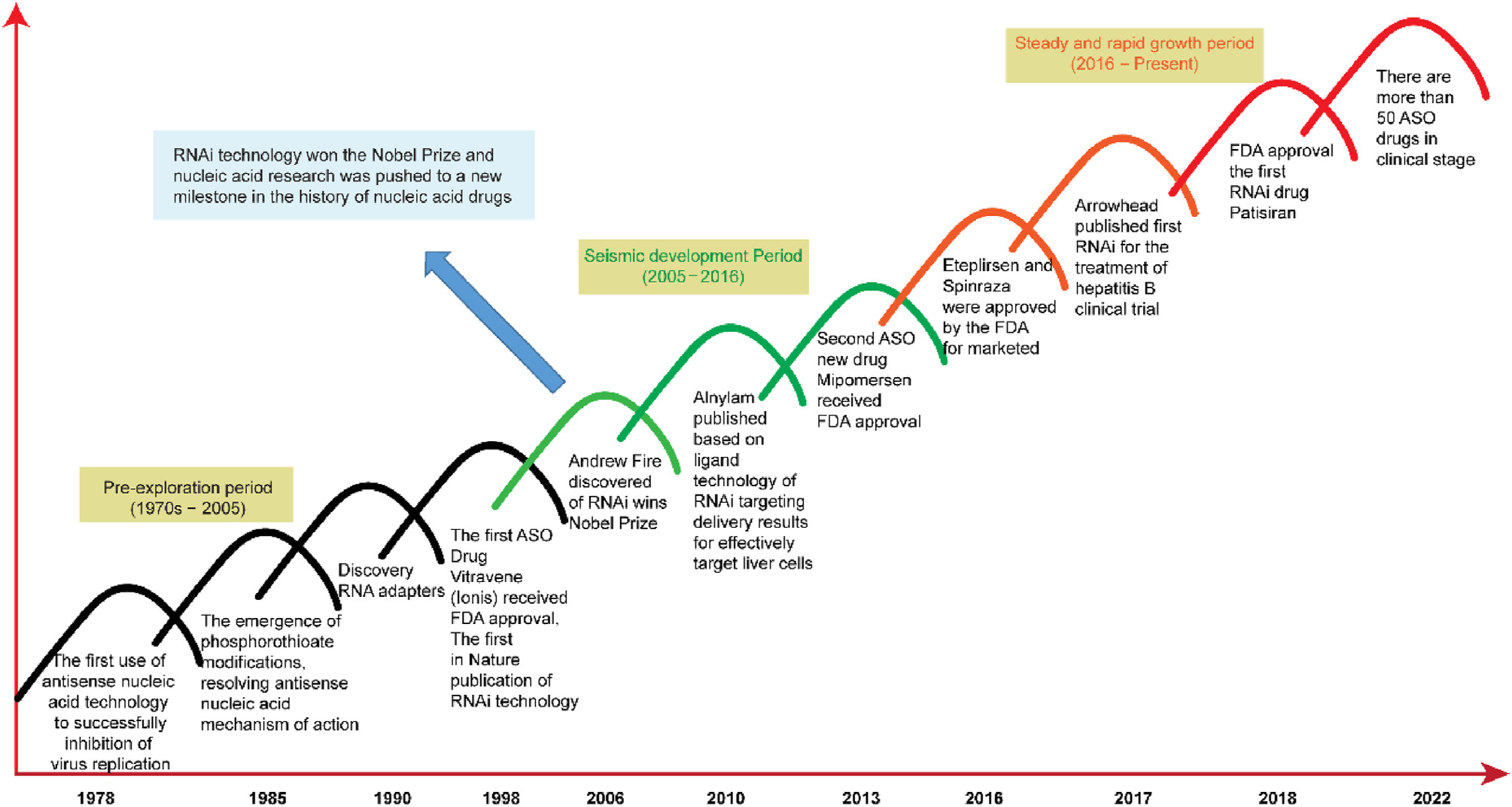
图1. 小核酸药物行业发展的里程碑事件[2]
机制原理:精准干预基因表达
小核酸药物主要包括小干扰RNA(siRNA)和反义寡核苷酸(ASO)等。以siRNA为例,其通过与靶标mRNA互补配对,引导RNA诱导沉默复合体(RISC)识别并降解特定mRNA,从而阻断蛋白质翻译,实现基因沉默。ASO则是单链寡核苷酸,通过与靶mRNA结合,招募RNase H降解mRNA,或者阻遏mRNA翻译及剪接等过程,最终下调目标蛋白表达[2]。
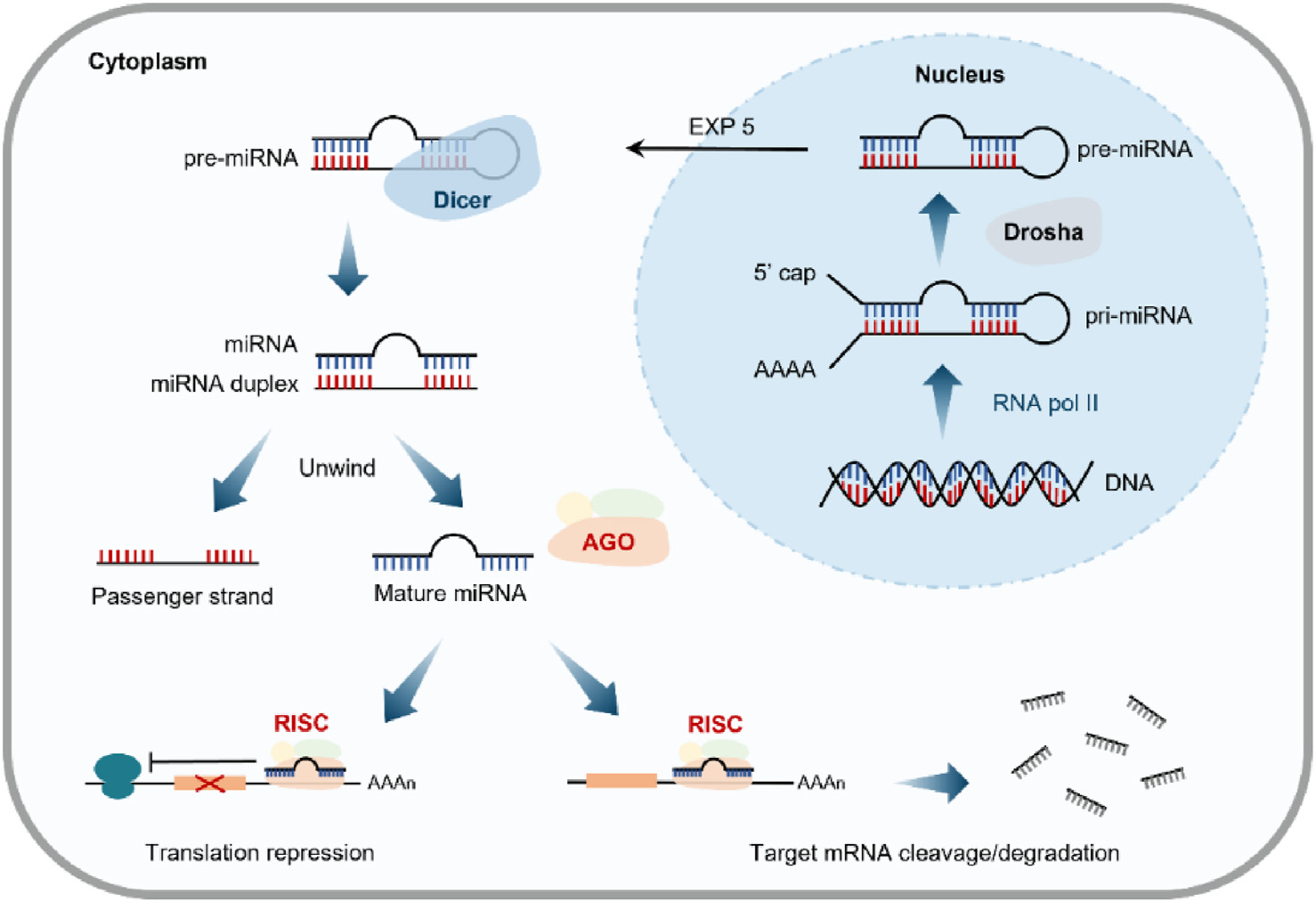
图2. siRNA作用机制[2]
小核酸药物具备研发周期相对较短、药效持久、研发成功率较高及治疗领域广阔等显著优势。相较于传统小分子药物和抗体药物,它不受限于蛋白质的“可成药性”,理论上,只要获知目标mRNA序列,即可设计出相应药物,有望攻克诸多当前无药可治的疾病。其长效特性在慢性病管理领域尤为重要,可大幅降低给药频率,实现疾病的长期稳定控制。这些独特优势赋予了小核酸药物巨大的市场潜力。
化学修饰与药物递送系统:小核酸药物破局关键
早期小核酸药物因稳定性差、递送效率低等问题发展受阻。随着技术进步,化学修饰策略与递送系统创新成为破局关键,使该领域重现生机。
• 化学修饰的突破
○ 相关修饰方式
1. 磷酸骨架修饰:如硫代磷酸(PS)修饰(用硫原子取代磷酸基团的一个非桥连氧原子),可增强核酸抗酶解能力、提升与血浆蛋白结合力,延长体内循环时间。
2. 核糖修饰:在核糖2'位引入特定基团(如2'-OMe、2'-MOE、2'-F)或进行锁核酸(LNA)修饰,能显著增强药物与靶mRNA的结合亲和力,抑制核酸酶降解,并降低体内免疫原性。
3. 碱基修饰:对碱基进行取代或替换(如用假尿苷替代尿嘧啶),可提高碱基对稳定性、药物对靶标序列的亲和力及核酸结构的化学活性,优化药物功能。
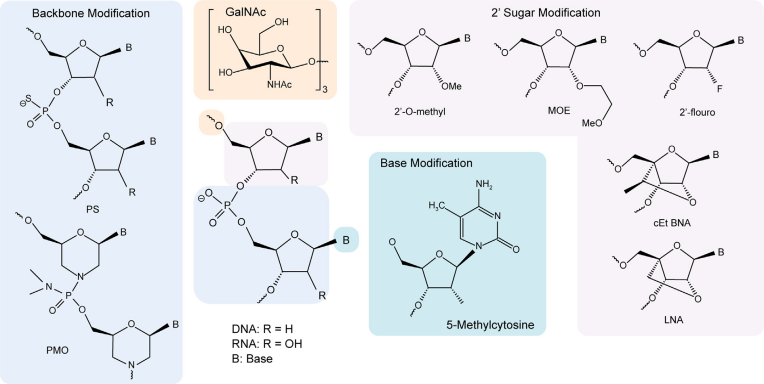
图3. 常用小核酸药物修饰方式[2]
○ 修饰技术的发展与应用
Alnylam的ESC平台通过提高2'-OMe含量,并在正义链和反义链的5'端各增加2个PS修饰,显著增强了药效并降低了副作用。例如,其研发的Vutrisiran,相比早期药物,临床剂量大幅降低,且药效维持时间更长。
• 递送系统的突破
1. 脂质纳米颗粒(LNP)递送系统:带正电的纳米脂质体可与带负电的RNA结合,将其包裹在脂质囊泡内,通过细胞膜融合将RNA释放至细胞质。LNP在包封效率、体内外表达效果及安全性方面表现优异,已被FDA批准用于静脉注射肝靶向siRNA治疗,以及肌内注射递送mRNA疫苗。Alnylam的Patisiran是首个采用LNP递送上市的siRNA药物。
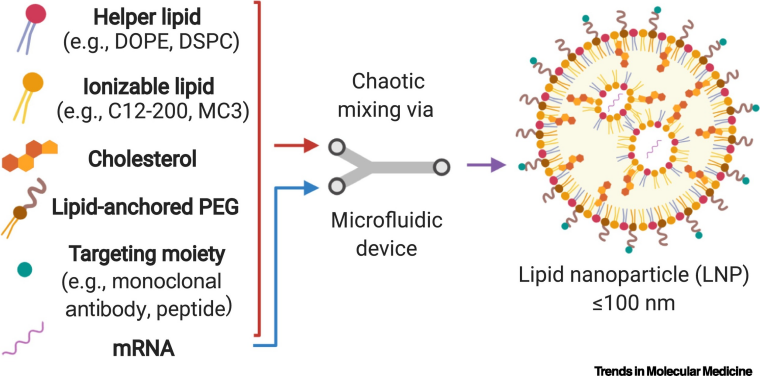
图4. LNP递送方式[5]
2. N-乙酰半乳糖胺(GalNAc)缀合递送系统:GalNAc技术有效解决了小核酸药物靶向性差、脱靶效应严重和稳定性差等痛点,在肝靶向领域实现重大突破。其支持皮下给药,具备更高效力、更长药效持续时间及更宽治疗窗口[3]。例如,Alnylam开发的Givosiran结合了增强化学稳定性的ESC-GalNAc技术,成功获得FDA批准。
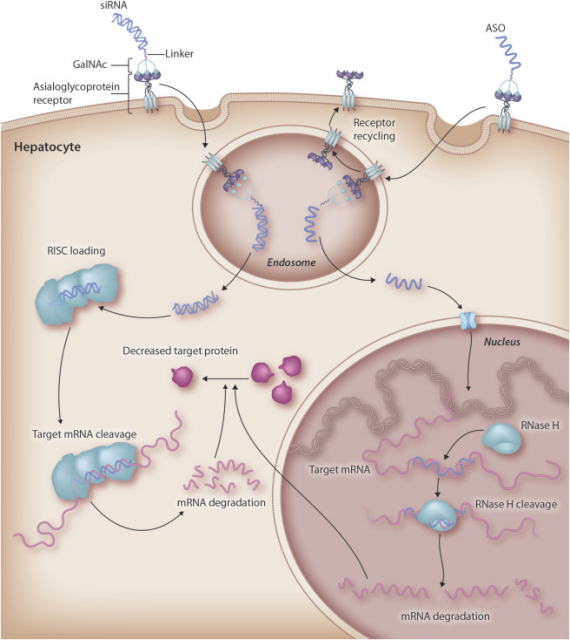
图5. 通过 GalNAc 靶向递送 siRNA 和 ASO[6]
前沿研究进展
• 技术迭代:Alnylam持续升级其化学修饰平台(从STC到ESC,再到Advanced ESC和ESC+),显著提升了siRNA药物的效力,同时降低了所需剂量和不良反应风险[4]。Dicerna则突破了Alnylam的GalNAc专利壁垒,建立了GalXC和GalXC-Plus RNAi平台,实现了肝靶向及肝外组织的靶向药物递送。
• 临床拓展:Arrowhead公司启动了ARO-ALK7治疗肥胖症的I/IIa期研究,这是首款进入临床、靶向脂肪组织表达基因的RNAi疗法。该疗法旨在通过沉默脂肪细胞中ACVR1C基因的表达来减少Activin受体样激酶7(ALK7)的产生,从而影响脂肪组织中能量稳态的调控通路。
小核酸药物研发支持:集萃药康模型资源
在小核酸药物的研发中,小鼠模型作为药物验证的“试金石”,关系到药物研发的成败。集萃药康提供该领域丰富的动物模型资源,为科研人员深入开展相关研究提供有力支持。具体应用中,靶点人源化小鼠解决物种差异,验证小核酸药物沉默效率与特异性;诱导疾病模型模拟病理状态,评估体内药效。两者结合能够助力科研人员更深入地探究小核酸药物的作用机制和疗效,加速其研发进程。
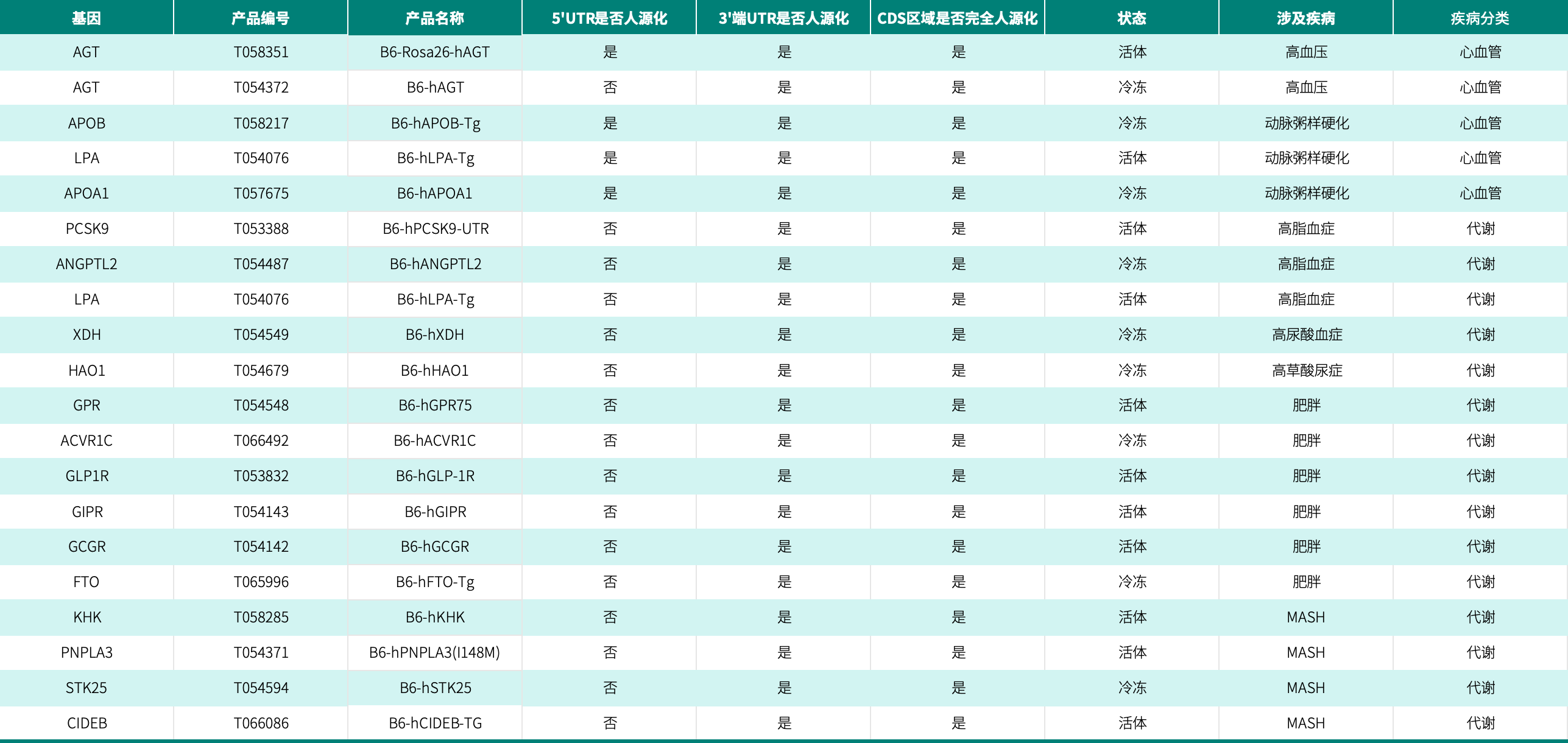
点击图片可查看电子表格
• 集萃药康小核酸药物临床前研究常用诱导型小鼠疾病模型
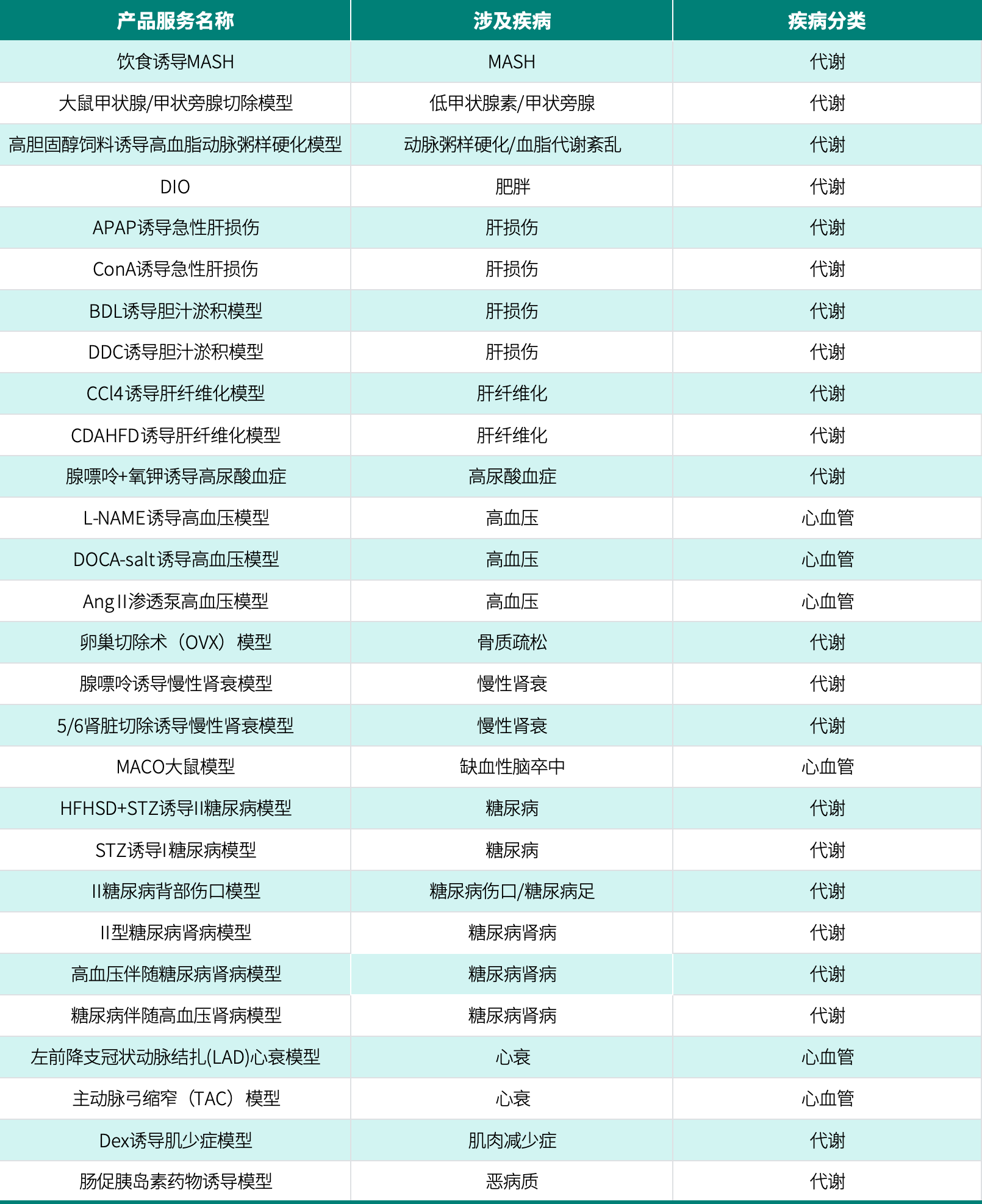
点击图片可查看电子表格
小核酸药物凭借其独特的作用机制和巨大的治疗潜力,正在引领生物医药领域的新一轮变革。随着技术持续突破和研究不断深入,其临床应用范围有望进一步拓宽。在这一进程中,集萃药康提供的动物模型等产品,将为科研人员提供强有力的工具支持,共同推动小核酸药物的研发进程和临床应用。

