世界乳腺癌防治月:关注乳腺癌ADC药物治疗耐药
针对Her-2的靶向药物开发已历经多代。2019年获批的ADC药物T-Dxd(商品名Enhertu)一定程度上解决了上一代ADC T-DM1耐药的问题。另外,其载荷Dxd保留了膜通透性,因此T-Dxd靶向过表达Her-2的肿瘤细胞后释放的Dxd也能够杀死邻近的不表达Her-2的细胞,这一 “旁观者效应” 使T-Dxd对Her-2 低表达的患者也具有较高的疗效。然而,T-Dxd的患者也无法摆脱耐药的结局。为了更好地研究T-Dxd耐药性,构建适当的临床前耐药模型是必要的。临床前耐药模型的构建策略主要有四种:PDX模型、体内诱导、体外诱导以及基因编辑(图1)。
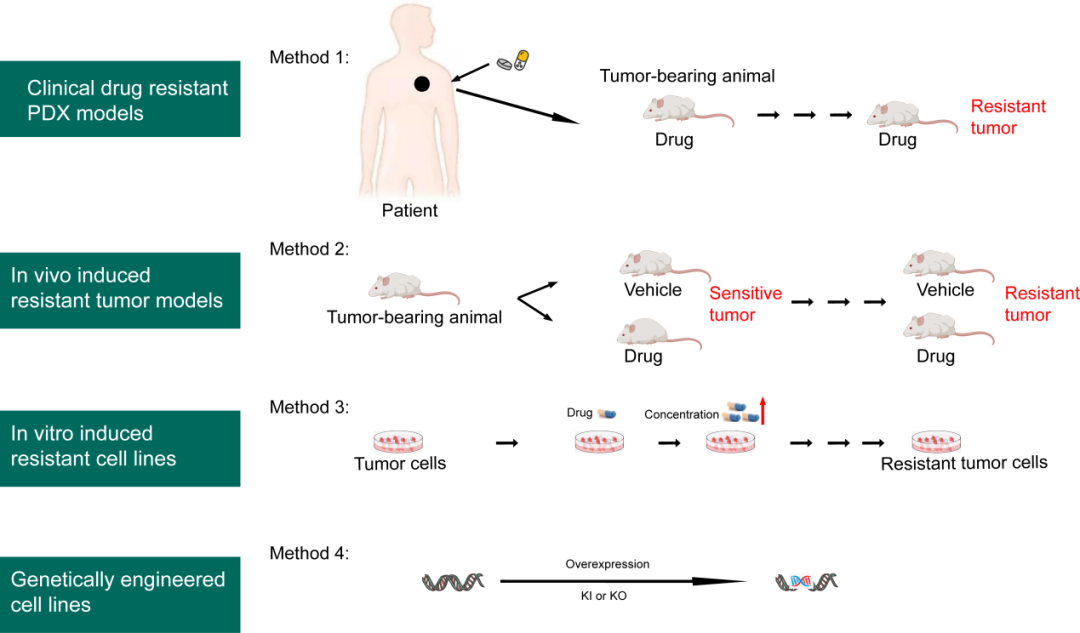
图 1. 临床前耐药模型构建的四种方法:
PDX模型,体内诱导,体外诱导以及基因编辑
每种方法各有其优缺点。PDX模型通过将耐药患者的肿瘤组织移植到免疫缺陷小鼠体内,其优势在于能够保留患者肿瘤组织的异质性,有助于针对特定患者开发个性化治疗方案。然而,PDX模型的缺点在于肿瘤移植后通常生长缓慢,且可重复性较差。体内诱导方法则是将已知的肿瘤细胞系接种到小鼠体内,通过多次给药诱导肿瘤产生耐药性。这种方法能够很好地模拟生理条件下耐药性的发展,但与体外筛选方法相比,周期依旧较长。体外诱导方法是在药物暴露环境中培养对药物敏感的肿瘤细胞系,并逐步增加药物浓度,最终形成耐药的肿瘤细胞系。该方法的特点是筛选速度较快,但可能面临体内转化率差的问题。基因编辑方法通过敲入或敲除某些影响药物敏感性的基因,从而使其产生耐药表型。在针对特定耐药机制的研究中,这种方法可以有效缩短建模周期,但无法全面反映肿瘤耐药的复杂性。
集萃药康采用体内诱导和体外诱导结合的方式,在BALB/c-Nude小鼠中构建了T-Dxd 耐药模型JIMT-1-Enhertu-R。T-Dxd对JIMT-1-Enhertu-R 的IC50是对其亲本细胞JIMT-1的4倍以上,耐药细胞对T-Dxd的敏感性显著降低。
JIMT-1-Enhertu-R的体内验证结果如图2所示,与亲本细胞JIMT-1相比,JIMT-1-Enhertu-R的在给定剂量下的生长没有受到明显抑制,且样本间差异较小。
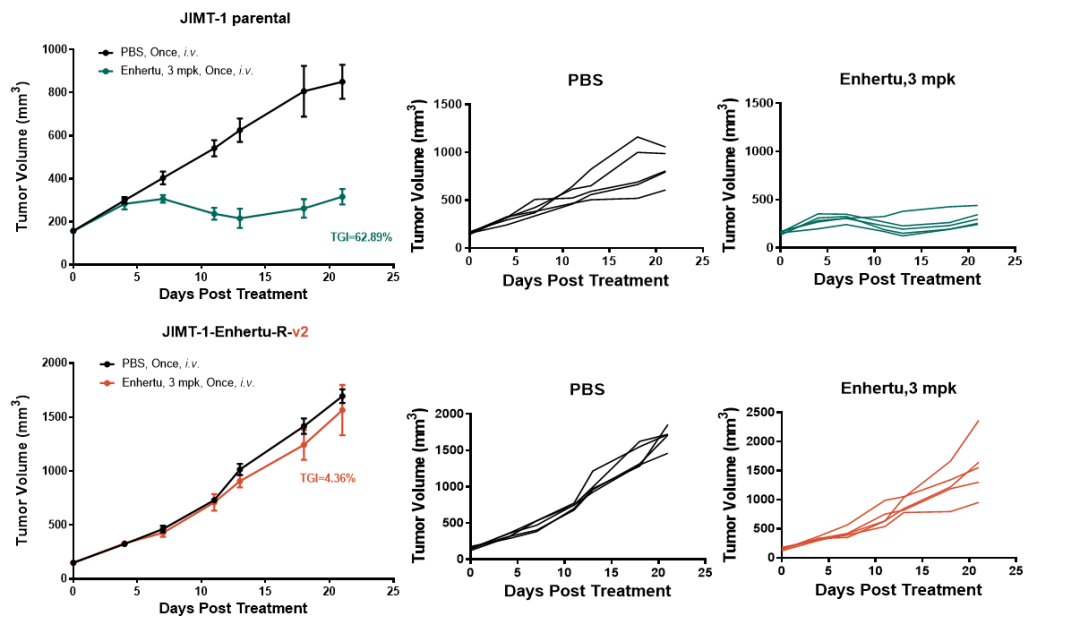
图 2. JIMT-1-Enhertu-R 的体内耐药验证 与亲本细胞JIMT-1相比,JIMT-1-Enhertu-R的在3mpk剂量下的生长没有受到明显抑制,且样本间差异较小
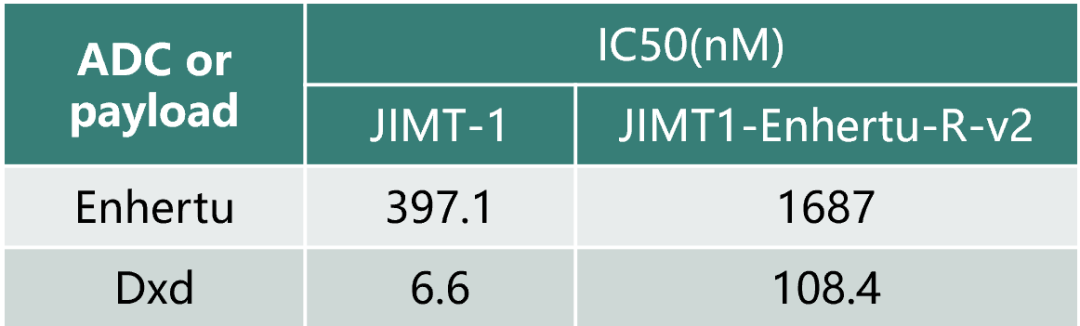
我们对JIMT-1-Enhertu-R的耐药机制也展开了初步探索。如图3所示,与亲本细胞JIMT-1相比,JIMT-1-Enhertu-R的Her-2表达水平没有明显降低;如表1所示,JIMT-1-Enhertu-R细胞对Dxd的耐药性显著增强,相较于JIMT-1增加了15倍以上。综上所述,初步推断JIMT-1-Enhertu-R的耐药机制可能与载荷相关而非Her-2的表达水平,同时该耐药株也可能具有交叉耐药的潜力。
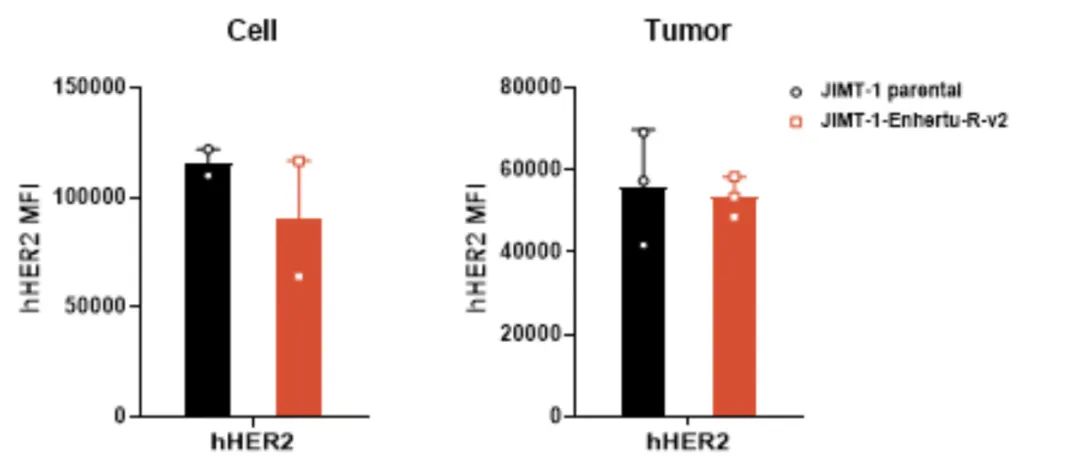
图 3. 体外和体内环境中JIMT-1与JIMT-1-Enhertu-R
平均荧光强度(MFI)无明显差异
表1、Enhertu 和Dxd对JIMT-1以及JIMT-1-Enhertu-R 的IC50
体内验证的IHC结果(图4)表明,JIMT-1-Enhertu-R组的Her-2 表达水平均为高表达,且与WT组相比均一性更好。
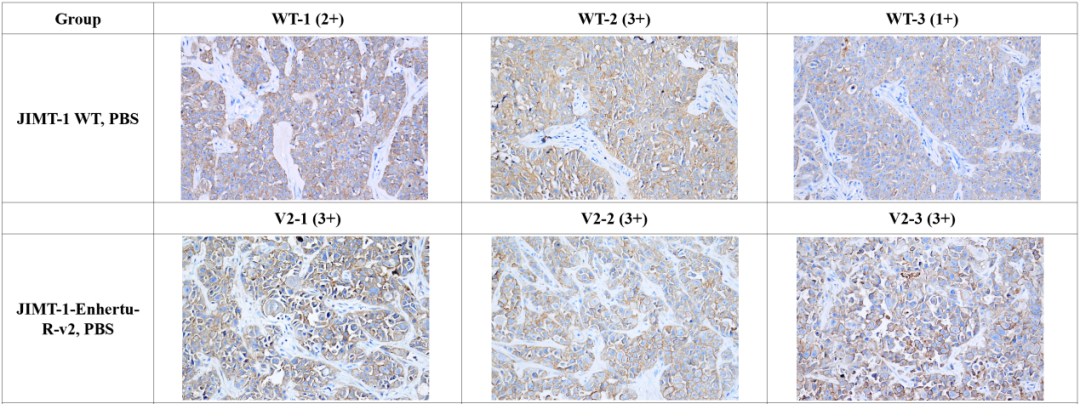
图4. HER2 在 JIMT-1 WT 和 JIMT-1-Enhertu-R
组织中的IHC染色结果
T-Dxd临床前耐药模型对于乳腺癌治疗的研究具有突出的价值。Enhertu作为最*新的Her2 靶向药物,与其可观的销售额相对应的是不可忽视的潜在耐药患者群体,其耐药模型有助于探索克服Her-2耐药的新疗法,包括新化学实体的筛选,ADC结构的优化以及联合疗法的开发。临床前耐药模型是理解耐药机制,探索治疗方法的重要工具,有助于研究人员在药物研发和疾病治疗领域取得更大的突破,为患者带来更多有效的治疗选择。
资源介绍
集萃药康在肿瘤耐药模型开发方面取得了显著成果,涵盖了多种耐药模型,包括PD1相关耐药模型、ADC诱导的耐药模型、EGFR-TKI耐药模型等。建模方法多样,包括自发耐药、体内诱导、体外诱导和基因编辑。目前,部分模型已上市,部分仍在开发中,具体资源列表如下:


