动物实验小鼠常见感染病菌螺杆菌诊断与防治!
9种螺杆菌可感染小鼠
螺杆菌属隶属于螺杆菌科,目前有30多个种,自1982年澳大利亚学者首次发现幽门螺杆菌以来,许多新螺杆菌属陆续从动物体内分离到。螺杆菌为革兰氏阴性菌,通常为螺旋形、纺锤形或弯曲状的,微需氧或厌氧,部分有鞭毛,在哺乳动物中引起胃肠或肝脏感染。目前已知至少有9种螺杆菌可感染小鼠(H. bilis、H. hepaticus、H. typhlonius、H. muridarum、H. rodentium、H. mastomyrinus、H. rappini、H. pullorum和H. ganmani),其中实验小鼠的临床疾病主要与胆汁螺杆菌(H.bilis)和肝螺杆菌(H.hepaticus)有关。
螺杆菌传播与感染实验小鼠途径
螺杆菌是实验小鼠中常见的病原体之一,人和动物均为其自然宿主,通常经粪口途径传播,可通过脏垫料接触传播给哨兵小鼠,在开放性饲养的笼架还可能通过粉尘的移动传播,在小鼠中曾有过肿瘤接种造成感染的相关报道,但几率极低。
螺杆菌分布广泛,在世界各地的小鼠群体中普遍存在。2007年调查动物研究机构中螺杆菌感染的流行率表明,在加拿大、欧洲、亚洲、澳大利亚和美国的商业和学术机构中约有88%螺杆菌阳性[2];丁聪等人在2011年对上海及周边地区的实验小鼠检测螺杆菌平均阳性率约为35%[1];从某第三方检测机构相关数据显示螺杆菌阳性率约为20%。近些年随着实验动物供应商加强对螺杆菌的清除,进行严格饲养管理后,螺杆菌的流行率有所降低。
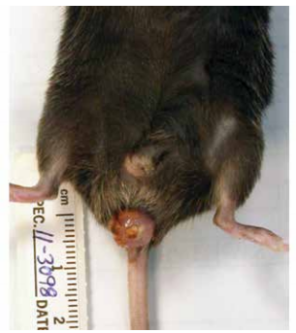
有也仅限于部分易感品系,目前已知肝螺杆菌可在部分易感小鼠如A/J C免疫正常小鼠感染螺杆菌后通常无明显症状,即使r品系中引起肝炎、肝肿瘤、胆固醇、胆结石、炎症性肠病或结肠癌。有研究发现C57BL/6小鼠感染螺杆菌后,虽无明显临床症状,但会影响妊娠,导致繁殖率下降。螺杆菌在部分近交系、转基因或免疫缺陷小鼠品系中具有致病性,并可能导致免疫损伤。免疫缺陷动物感染螺杆菌后主要的临床症状是直肠脱出和腹泻,并可能继发盲肠炎和结肠炎。尸检可见肿大的盲肠或结肠,严重时伴有直肠脱垂以及肠系膜淋巴结肿大。严重结肠炎时可在盲肠-结肠交界处见典型的增生变化。常见的螺杆菌,很少在啮齿动物胃内定植,因此少见胃炎表现。
图片来自参考文献[7]
螺杆菌的诊断和其对研究的影响
大多数免疫正常小鼠感染螺杆菌能够通过血清学方法检测到,但血清抗体反应产生存在延迟易出现假阴性,并且其特异性较差。通过粪便PCR检测螺杆菌是目前检测螺杆菌最 好的方法,已被广泛应用于实验小鼠,并且可以在种属水平进行鉴定和分型。
螺杆菌会引起小鼠肝脏或肠道的炎性反应,影响消化系统的相关研究,并且易感小鼠品系感染肝螺杆菌还可能会影响致癌性研究。此外,螺杆菌诱导的炎症反应可能改变小鼠的免疫反应会干扰实验进行,因此检测和消除螺杆菌是很重要的。
那这么常见的细菌要如何预防和处理呢?
与任何感染源一样,必须对进入设施的活体动物的微生物质量进行严格控制,定期进行哨兵动物的健康监控。并且因为螺杆菌对环境中的抵抗性不强,在干燥的空气中暴露8小时即死亡,保持良好的日常消毒是预防螺杆菌的有效措施。
国家标准没有对螺旋杆菌做明确要求,但小吉很早就关注螺杆菌的检测,我们自2006年开始进行螺杆菌的检测,摸索并建立了螺杆菌的检测方法,在这十几年中不断优化,从最初对肝型、胆囊型螺杆菌的检测,变更为螺旋杆菌属的检测,设施内小鼠种群已经连续十几年保持螺杆菌阴性的状态。目前在设施中按照每三个月的频率对螺杆菌进行PCR检测,检测对象覆盖哨兵鼠、品系抽检鼠以及净化后代动物。
如果已经发生螺杆菌感染,可以通过剖腹产或胚胎移植的方法进行净化,也可以在新生小仔出生后24小时内交给无螺杆菌的雌鼠代乳,这种方法称为“Cross-foster”。这种方法的优点是技术要求低,配合对受感染的怀孕小鼠的药物治疗和增加换笼频率效果会更好,但是需注意在免疫缺陷小鼠中可能经子宫内感染肝螺杆菌,此类方法不能达到净化目的。受螺杆菌感染的小鼠可以采用抗生素治疗,使用阿莫西林、甲硝唑和铋的三联疗法药物已有商业化产品,但无法根除感染,胚胎移植是最有效的净化方法。
【参考资料】:
1.丁聪, 冯洁, 谢建云, 等. 两种方法对上海及周边地区实验大小鼠螺杆菌携带情况的调查[J]. 中国比较医学杂志, 2011, 21(12): 66-69.
2.Taylor N S, Xu S, Nambiar P, et al. Enterohepatic Helicobacter species are prevalent in mice from commercial and academic institutions in Asia, Europe, and North America[J]. Journal of clinical microbiology, 2007, 45(7): 2166-2172.
3.Jury J, Gee L C, Delaney K H, et al. Eradication of Helicobacter spp. from a rat breeding colony[J]. Journal of the American Association for Laboratory Animal Science, 2005, 44(4): 8-11.
4.Artwohl J E, Purcell J E, Fortman J D. The use of cross-foster rederivation to eliminate murine norovirus, Helicobacter spp., and murine hepatitis virus from a mouse colony[J]. Journal of the American Association for Laboratory Animal Science, 2008, 47(6): 19-24.
5.Hayashimoto N, Morita H, Ishida T, et al. Current microbiological status of laboratory mice and rats in experimental facilities in Japan[J]. Experimental animals, 2013, 62(1): 41-48.
6.Johansson S K, Feinstein R E, Johansson K E, et al. Occurrence of Helicobacter species other than H. hepaticus in laboratory mice and rats in Sweden[J]. Comparative medicine, 2006, 56(2): 110-113.
7.Duangchanchot M, Inpunkaew R, Thongsiri P, et al. Prevalence of Helicobacter in Laboratory Micein Thailand[J]. Experimental Animals, 2014, 63(2): 169-173.
8.Kim H, Bang J, Baek S H, et al. Eliminating murine norovirus, Helicobacter hepaticus, and intestinal protozoa by embryo transfer for an entire mouse barrier facility[J]. Experimental Animals, 2022, 71(1): 28-35.